题目内容
17.根据化学反应原理的相关知识,请回答下列问题(1)常温下1g CH4完全燃烧并生成液态水,放出55.6kJ的热量,写出CH4燃烧的热化学方程式:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ/mol.
(2)固态硫加热形成气态硫要吸收能量:1mol固态硫燃烧生成二氧化硫气体的焓变为△H1;1mol气态硫燃烧生成二氧化硫气体的焓变为△H2,则△H1>△H2
(3)向一体积不变的密闭容器中加入2molNO2气体,发生反应2NO2(g)?N2O4(g),反应达平衡后,NO2的转化率为a,在温度不变的条件下,再向该容器加入2molNO2气体,反应重新达平衡后,NO2的转化率为b,则a<b(填“>”“=”“<”,)
(4)在25℃下,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合,反应平衡时溶液中c(NH${\;}_{4}^{+}$)=c(Cl-),则溶液显中(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$.
分析 (1)计算1mol甲烷完全燃烧生成液态水放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(2)据固态硫加热形成气态硫要吸收能量,所以气态硫能量高结合△H=生成物的能量-反应物的能量解答.
(3)据压强增大时,平衡向气体体积减小的方向移动分析;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$.
解答 解:(1)1molCH4在氧气中燃烧生成CO2和液态水,放出热量为55.6kJ×$\frac{1mol×16×g/mol}{1g}$=889.6kJ热量,
则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ/mol;
(2)固态硫加热形成气态硫要吸收能量,所以气态硫能量高,又△H=生成物的能量-反应物的能量,1mol固态硫燃烧生成二氧化硫气体比1mol气态硫燃烧生成二氧化硫气体放出的热量少,则△H大,故答案为:>;
(3)体积不变,温度不变的条件下,再向该容器加入1molN2O4,由于生成物浓度增大,平衡逆向移动,但逆向移动时压强增大,所以,移动的结果不如原平衡,所以,N2O4的体积分数比原平衡大,故答案为:<;
(4)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×5×1{0}^{-3}}{0.5a-5×1{0}^{-3}}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:中,$\frac{1{0}^{-9}}{a-0.01}$;
点评 本题考查弱电解质电离,热化学方程式的焓变的大小比较,根据电荷守恒确定溶液酸碱性,结合一水合氨电离平衡常数解答问题,注意二者混合后溶液体积增大一倍,物质浓度降为原来一半,为易错点,题目难度不大.

| A. | NaNO3 | B. | Na2CO3 | C. | NaHCO3 | D. | Na2SO4 |
 25℃时,部分物质的电离常数如表所示:
25℃时,部分物质的电离常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)a.CH3COOH,b.H2CO3,c.HClO的酸性由强到弱的顺序为a>b>c(填编号).
(2)同浓度的a.CH3COO-,b.HCO${\;}_{3}^{-}$,c.CO${\;}_{3}^{2-}$,d.ClO-结合H+的能力由强到弱的顺序为c>d>b>a(填编号).
(3)向NaClO溶液中通入少量的CO2,反应的离子方程式为ClO-+CO2+H2O=HCO3-+HClO.
(4)pH相同的下列四种物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,物质的量浓度由大到小的顺序是c>d>b>a(填编号).
(5)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是A(填序号).
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)•c(OH-) D. c(H+)•c(CH3COO-)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是ABCD.
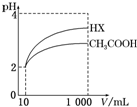
(6)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程中pH变化如图所示,则HX的电离常数大于(填“大于”、“等于”或“小于”)醋酸的电离常数;稀释后,HX溶液中由水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+).
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 |
(2)B仪器的作用是使挥发的产物SO2Cl2冷凝回流;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择A;
A.冰水浴 B.常温 C.加热至69.1℃D.沸水浴
(4)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应.充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收.分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式SO2Cl2+2H2O=H2SO4+2HCl;反应完成后,在W溶液、烧杯中分别滴加过量的BaCl2溶液,均出现白色沉淀,此沉淀不溶于稀盐酸,经过滤、洗涤、干燥,称量得到的固体质量分别为X g、Y g.计算SO2+Cl2?SO2Cl2反应中,SO2的转化率为(用含X、Y的代数式表示)$\frac{x}{x+y}$×100%.
| A. | 氢氟酸不能存放于玻璃瓶中 | |
| B. | 氯水存放于棕色试剂瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 氢氧化钠溶液存放于玻璃塞的试剂瓶中 |
b.2CH4(g)═C2H4(g)+2H2(g)△H>0.根据上述变化,判断以下几个热化学方程式:
①C(s)+2H2(g)═CH4(g)△H=-$\frac{1}{2}$Q1 kJ/mol
②2C(s)+H2(g)═C2H2(g)△H=-Q2 kJ/mol
③2C(s)+2H2(g)═C2H4(g)△H=-Q3 kJ/mol,其中Q1、Q2、Q3从大到小的顺序是( )
| A. | Q1>Q3>Q2 | B. | Q1>Q2>Q3 | C. | Q2>Q1>Q3 | D. | Q3>Q2>Q1 |
| 选项 | 反应叙述 | 产物图示 |
| A | NaOH溶液与SO2 反应时溶液中的溶质 | 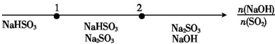 |
| B | NaAlO2溶液与盐酸反 应后铝元素的存在形式 |  |
| C | Fe和稀HNO3反应 后,铁元素的存在形式 |  |
| D | Fe在Cl2中的燃烧产物 |  |
| A. | A | B. | B | C. | C | D. | D |
| A. | 不小心将少量浓硫酸沾到皮肤,立即用水冲洗 | |
| B. | 如果不慎将碱液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液 | |
| C. | 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中 | |
| D. | 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装 |
(1)合成氨的原料气N2和H2通常是以焦炭、水和空气为原料来制取的.其主要反应是:①2C+O2→2CO ②C+H2O(g)→CO+H2 ③CO+H2O(g)→CO2+H2
某次生产中将焦炭、H2O(g)和空气(设空气中N2和O2的体积比为4:1,下同)混合反应,所得气体产物经分析,组成如下表:则表中x=44m3.
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
N2(g)+O2(g)?2NO(g)△H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡.测得NO为8×10-4mol.计算该温度下的平衡常数K=4×10-6;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移.
(3)SO2和氮的氧化物都是空气中的有害气体,已知:
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
(4)25℃时,电离平衡常数:
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
a.常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系不正确的是AD
A.c(Na+)>c(ClO-)>c(HCO3-)>c(OH-)
B.c(Na+)>c(HCO3-)>c(ClO-)>c(H+)
C.c(Na+)═c(HClO)+c(ClO-)+c(HCO3-)+c(H2CO3)+c(CO32-)
D.c(Na+)+c(H+)═c(ClO-)+c(HCO3-)+2c(CO32-)
E.c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-)
b.常温下,0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2c(C4H4O62-)=(0.05+10-6-10-8)mol/L.(列出计算式)