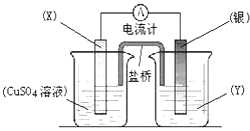
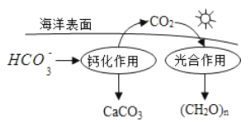
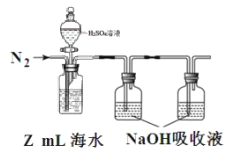
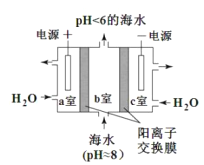
题目内容
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知: ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) Δ H=+93.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)=CO2(g)+2H2(g) Δ H=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) Δ H=-38.19 kJ·mol-1
则表示 CH3OH 的燃烧热的热化学方程式为___________ 。
(2)在一定条件下用CO和H2合成 CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。
CH3OH(g),在2 L恒容密闭容器中充入1mol CO和2mol H2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。

回答下列问题:
①该反应的反应热 Δ H________ 0(填“>” 或“<” ),压强的相对大小与p1_______ p2(填“>” 或“<” )。
②压强为 p2,温度为 300℃时,该反应的化学平衡常数的计算式为K=_______(只列算式不计算结果)。
③下列各项中,不能说明该反应已经达到平衡的是_______。
A.容器内气体压强不再变化
B.υ (CO):υ (H2)=1:2
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, 平衡_______。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
【答案】 CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) Δ H=-726.51 kJ·mol-1 < > ![]() BC C
BC C
【解析】(1)已知: ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) Δ H1=+93.0 kJ·mol-1
②CH3OH(g)+1/2 O2(g)=CO2(g)+2H2(g) Δ H2=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) Δ H3=-38.19 kJ·mol-1
根据盖斯定律,由②×3- ①×2-③得反应CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) Δ H=Δ H2×3-Δ H1×2-Δ H3=-726.51 kJ·mol-1;(2)①随着温度升高,甲醇的体积分数减少,根据勒夏特列原理,升高温度,平衡向吸热反应的逆方向移动,即正反应为放热反应,Δ H<0;作等温线,随着压强增大,平衡向体积减小的正方向移动,根据图表可知p1>p2;②压强为 p2,温度为 300℃时,CH3OH的体积分数为50%,设CO的转化率为x则CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol/L) 0.5 1 0
改变浓度(mol/L) 0.5x x 0.5x
平衡浓度(mol/L) 0.5-0.5x 1-x 0.5x
CH3OH的体积分数为![]() ×100%=50%,解得x=0.75,该反应的化学平衡常数的计算式为K=
×100%=50%,解得x=0.75,该反应的化学平衡常数的计算式为K=![]() =
=![]() ;③A、反应前后气体系数之和不相等, 则压强不变,说明反应达到平衡,选项A不选;B、没有指明反应的方向,不能说明正逆反应速率相等,则不能证明达到平衡状态,选项B选;C、根据密度的定义,恒容说明体积不变,组分都是气体,质量不变,密度不变,不能说明反应达到平衡,选项C选;D、根据平均摩尔质量的定义,气体质量不变,反应前后气体系数之和不相等,气体物质的量减少,因此平均摩尔质量不变,说明达到平衡状态,选项D不选;E、根据化学平衡状态的定义,当组分的质量分数不变,说明反应达到平衡,选项E不选。答案选BC;④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc=
;③A、反应前后气体系数之和不相等, 则压强不变,说明反应达到平衡,选项A不选;B、没有指明反应的方向,不能说明正逆反应速率相等,则不能证明达到平衡状态,选项B选;C、根据密度的定义,恒容说明体积不变,组分都是气体,质量不变,密度不变,不能说明反应达到平衡,选项C选;D、根据平均摩尔质量的定义,气体质量不变,反应前后气体系数之和不相等,气体物质的量减少,因此平均摩尔质量不变,说明达到平衡状态,选项D不选;E、根据化学平衡状态的定义,当组分的质量分数不变,说明反应达到平衡,选项E不选。答案选BC;④某温度下,在保证 H2 浓度不变的情况下,增大容器的体积, c(CH3OH)与c(CO)同等倍数减小,根据浓度商Qc=![]() ,推得 Qc=K,所以平衡不移动,答案选C。
,推得 Qc=K,所以平衡不移动,答案选C。

【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0