题目内容
3.2g铜与过量硝酸(8mol?L-1,100mL)充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含a mol H+,则此时溶液中所含NO3-的物质的量是( )
| A、0.2+a | B、0.1+a |
| C、0.05+a | D、a |
考点:化学方程式的有关计算
专题:计算题
分析:铜与过量硝酸反应,反应后溶液中的溶质是硝酸和硝酸铜,根据硝酸中NO3-和H+、硝酸铜中NO3-和Cu2+的关系式,由H+、Cu2+的量计算NO3-的物质的量.
解答:
解:3.2g的物质的量为
=0.05mol,
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--Cu--2NO3-
1 2
0.05mol x
=
,解得x=0.1mol,
HNO3--H+--NO3-
1 1
amol ymol
y=amol,
则此时溶液中含有NO3-的物质的量为(0.1+a)mol
故选B.
| 3.2g |
| 64g/mol |
设Cu2+对应的NO3-为xmol,
H+对应的NO3-为ymol,
Cu(NO3)2--Cu2+--Cu--2NO3-
1 2
0.05mol x
| 1 |
| 2 |
| 0.05mol |
| x |
HNO3--H+--NO3-
1 1
amol ymol
y=amol,
则此时溶液中含有NO3-的物质的量为(0.1+a)mol
故选B.
点评:本题考查的是硝酸的性质及守恒法的计算,为高频考点,把握原子守恒的计算为解答的关键,在做题时要灵活运用,不能生搬硬套,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
下列装置或操作能达到实验目的是( )
A、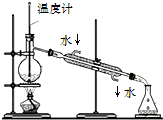 蒸馏石油 |
B、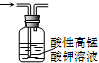 除去甲烷中少量乙烯 |
C、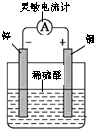 验证化学能转变电能 |
D、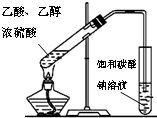 制取乙酸乙酯 |
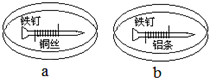 如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )
如图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )| A、a中铁钉附近呈现红色 |
| B、b中铝条附近有气泡产生 |
| C、a中铜丝上发生氧化反应 |
| D、b中铁钉上发生还原反应 |
下列有关实验操作正确的是( )
| A、用Ba(NO3)2溶液可以鉴别SO32-和SO42- |
| B、做H2还原CuO实验时要先通氢气,验纯后再加热 |
C、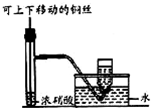 采用如图所示装置可制备并收集少量NO2气体 |
| D、测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸 |
生活中常用到一些化学知识,下列说法中不正确的是( )
| A、医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水 |
| B、未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 |
| C、某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中的亚硫酸逐渐被空气中氧气氧化成硫酸 |
| D、棉花和木材的主要成分都是纤维素,蚕丝和蜘蛛丝的主要成分都是蛋白质 |
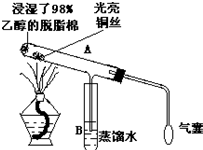 有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图:
有关催化剂的催化机理等问题可从“乙醇催化氧化”实验得到一些认识,其实验装置如图: