题目内容
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)基态亚铜离子价电子排布式为____________;第一电离能I(Cu)________I (Zn)(填“>”或“<”)原因__________________________________________;
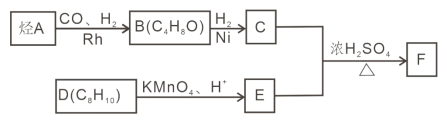
(2)Cu(CH3CN)42+比四氨合铜离子还稳定,配离子中Cu的配位数是_______,配体中碳原子的杂化类型是_________________,1molCH3CN中σ键的个数为_____________;
(3)CuCl是有机合成中常见催化剂。CuCl熔化后几乎不导电,推测CuCl晶体中化学键类型为_________;CuCl加强热会分解生成铜,铜晶体的堆积方式为__________(用文字表示)。
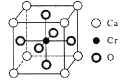
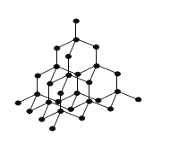
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(A—H…B)为_______________pm(列式并计算)。(0℃时冰密度为0.9g˙cm-3)![]()
【答案】3d10<Cu的价电子排布式3d104s1 易失去最外层的一个电子,形成3d 上的全满较稳定结构,Zn的价电子排布式3d104s2 就是较稳定结构不易失去一个电子,所以第一电离能I(Cu) < I (Zn)4sp3、sp杂化5NA共价键面心立方最密堆积
【解析】
(1)基态铜原子核外有29个电子,根据洪特规则可知,当3d轨道排布10个电子为全充满结构时,原子能量最低,所以基态铜原子价电子排布式为3d10 4s1;基态亚铜离子价电子排布式为3d10;锌原子最外层为4s2全充满结构,不易失去一个电子,而Cu原最外层为4s1半充满结构, 易失去最外层的一个电子,所以第一电离能I(Cu) < I (Zn);正确答案; 3d10 , <,Cu的价电子排布式3d104s1 易失去最外层的一个电子,形成3d 上的全满较稳定结构,Zn的价电子排布式3d104s2 就是较稳定结构不易失去一个电子,所以第一电离能I(Cu) < I (Zn)。
(2)Cu2+能够与4个CH3CN基团形成4个配位键,所以配离子中Cu的配位数是4;配体CH3CN中,-CH3中杂化轨道数=孤电子对数+σ个数=0+4=4,属于sp3杂化;-C≡N结构中:杂化轨道数=孤电子对数+σ个数=0+2=2,属于sp杂化;1molCH3CN结构简式为:CH3-C≡N,含有的σ键数为(3+1+1)×NA= 5NA;正确答案: 4, sp3、sp杂化,5NA。
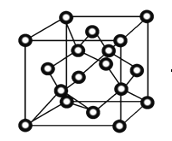
(3)CuCl熔化后几乎不导电,则CuCl晶体属于共价化合物,存在共价键;铜晶体中铜原子堆积方式为面心立方最密堆积;正确答案:共价键; 面心立方最密堆积。
(4)每个冰晶胞平均含有水分子数为:8×1/8+6×1/2+4=8(其中顶点为8个,面心为6个,晶胞内有4个),则晶胞的质量18×8g,设晶胞的棱长为rcm,该晶胞的体积=r3=(18×8)/NA×0.9cm3,所以r= cm,冰晶胞中体对角线长为
cm,冰晶胞中体对角线长为![]() r,设冰晶体中氢键的键长为acm,则a=
r,设冰晶体中氢键的键长为acm,则a=![]() =
= ;正确答案:
;正确答案: 。
。

 阅读快车系列答案
阅读快车系列答案