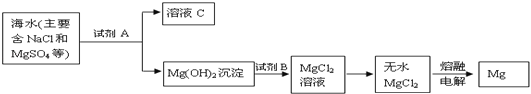
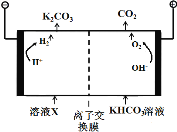
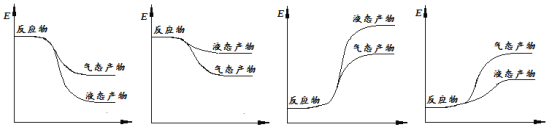
题目内容
【题目】已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196 kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2molSO2和0.1molO2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是
2SO3(g) △H=-196 kJ/mol。某温度下,向一体积为2L的密闭容器中充入0.2molSO2和0.1molO2,5min后达到平衡,共放出热量11.76kJ,下列说法正确的是
A.5min内用O2表示的反应速率为0.12mol/(L·min)
B.加入催化剂,可使该反应的化学反应速率加快,△H变小
C.SO2的平衡浓度为0.12mol/L
D.达到平衡时,若增大容器的体积,则该反应的化学反应速率减慢
【答案】D
【解析】
试题分析:A.根据热化学方程式,1mol O2完全反应放出196kJ的热量,5min后达到平衡,共放出热量11.76kJ,则参加反应的氧气的物质的量为11.76kJ÷196kJ/mol=0.06mol,则5min内用O2表示的反应速率为0.06mol ÷ (2L × 5min) = 0.006 mol / (L·min),A项错误;B.催化剂只能改变化学反应速率,不能改变平衡,即△H值不变,B项错误;C.根据上述分析,参加反应的氧气为0.06mol,则参加反应的SO2为0.12mol,所以SO2的平衡浓度为(0.2-0.12)mol÷2L=0.04mol/L,C项错误;D.达到平衡时,若增大容器的体积,则减小压强,该反应的化学反应速率减慢,D项正确;答案选D。

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目