��Ŀ����
����Ŀ������������CO2���ڻ��ۣ���в����̬����������������ܵ�ȫ�����ע��
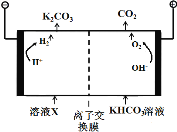
(1)��ҵ�ϳ��ø�Ũ�ȵ�K2CO3 ��Һ����CO2������ҺX�������õ�ⷨʹK2CO3 ��Һ��������װ��ʾ��ͼ���£�
���������������ķ�Ӧ���� ��H++HCO3-![]() H2O+CO2����
H2O+CO2����
������CO32-��������������ԭ�� ��
(2)����װ���в�����CO2��H2��һ�������·�Ӧ���ɼ״��Ȳ����ҵ�����ø÷�Ӧ�ϳɼ״�����֪��25 ����101 KPa����
H2(g)+![]() O2(g)
O2(g)![]() H2O(g)��H1=-242kJ��mol��1
H2O(g)��H1=-242kJ��mol��1
CH3OH(g)+![]() O2(g)
O2(g)![]() CO2(g)+2H2O(g)��H2=-676kJ��mol��1
CO2(g)+2H2O(g)��H2=-676kJ��mol��1
��д��CO2��H2������̬�״��Ȳ�����Ȼ�ѧ����ʽ ��
�������ʾ�ϳɼ״��ķ�Ӧ�������仯ʾ��ͼ��������ȷ���� (����ĸ���)��
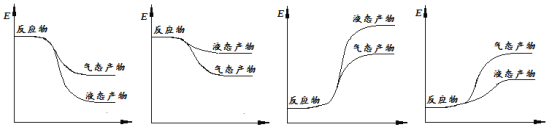
A B C D
(3)����ȼ�ϵ����һ���������ォ��ѧ��ֱ��ת���ɵ��ܵ�װ�á���֪ij�ּ״�����ȼ�ϵ���У��������ҺΪ���ԣ�ʾ��ͼ���£�
 ��
��
���õ�����·���ӵ���������Ϊ (��д����A��B��������B��A��)��
��A�缫�����״������ĵ缫��ӦʽΪ ��
���𰸡�
(1)��4OH�C��4e-=2H2O+O2������HCO3�C���ڵ���ƽ�⣺HCO3�C![]() H++CO32-������H+�ŵ�Ũ�ȼ�Сƽ��������(������H+�ŵ�OH-Ũ��������OH-��HCO3�C��Ӧ����CO32-)
H++CO32-������H+�ŵ�Ũ�ȼ�Сƽ��������(������H+�ŵ�OH-Ũ��������OH-��HCO3�C��Ӧ����CO32-)
(2)��CO2(g)+3H2(g)=CH3OH(g)+H2O(g)��H=��50kJ��mol��1����A
(3)����A��B����CH3OH+H2O-6e-=6H++CO2��
��������
���������(1)�����������������ӷŵ�����������ˮ���缫��ӦʽΪ4OH--4e-�T2H2O+O2�����ʴ�Ϊ��4OH--4e-�T2H2O+O2������HCO3-���ڵ���ƽ����HCO3-H++CO32-������H+�ŵ�Ũ�ȼ�Сƽ��������CO32-����������H+�ŵ�OH-Ũ��������OH-��HCO3-��Ӧ����CO32-��CO32-�������ʴ�Ϊ��HCO3-���ڵ���ƽ����HCO3-![]() H++CO32-������H+�ŵ�Ũ�ȼ�С��ƽ��������CO32-����������H+�ŵ�OH-Ũ��������OH-��HCO3-��Ӧ����CO32-��CO32-������
H++CO32-������H+�ŵ�Ũ�ȼ�С��ƽ��������CO32-����������H+�ŵ�OH-Ũ��������OH-��HCO3-��Ӧ����CO32-��CO32-������
(2)��H2(g)+![]() O2(g)�TH2O(g)��H1=-242kJ/mol����CH3OH(g)+
O2(g)�TH2O(g)��H1=-242kJ/mol����CH3OH(g)+![]() O2(g)�TCO2(g)+2H2O(g) ��H2=-676kJ/mol ����������ʽ3��-����CO2(g)+3H2(g)�TCH3OH(g)+H2O(g)��H =3��(-242kJ/mol)-(-676kJ/mol) =-50 kJ/mol���ʴ�Ϊ��CO2(g)+3H2(g)�TCH3OH(g)+H2O(g)��H=-50 kJ/mol�����÷�Ӧ�Ƿ��ȷ�Ӧ����Ӧ������������������������������Խ�ȶ���������ԽС������Һ̬���ʵ�����С����̬�����������������ͼ����A����ѡA��
O2(g)�TCO2(g)+2H2O(g) ��H2=-676kJ/mol ����������ʽ3��-����CO2(g)+3H2(g)�TCH3OH(g)+H2O(g)��H =3��(-242kJ/mol)-(-676kJ/mol) =-50 kJ/mol���ʴ�Ϊ��CO2(g)+3H2(g)�TCH3OH(g)+H2O(g)��H=-50 kJ/mol�����÷�Ӧ�Ƿ��ȷ�Ӧ����Ӧ������������������������������Խ�ȶ���������ԽС������Һ̬���ʵ�����С����̬�����������������ͼ����A����ѡA��
(3)����ȼ�ϵ���У��״�ʧ���ӷ���������Ӧ������A�Ǹ�����B�����������ӴӸ���A��������B���ʴ�Ϊ����A��B����A�缫�ϼ״�ʧ���Ӻ�ˮ��Ӧ���������ӺͶ�����̼���缫��ӦʽΪ��CH3OH+H2O-6e-�T6H++CO2�����ʴ�Ϊ��CH3OH+H2O-6e-�T6H++CO2����

 ��У����ϵ�д�
��У����ϵ�д�