题目内容
8.下列电离方程式错误的是( )| A. | NaHCO3═Na++H++CO32- | B. | NaHSO4(溶液)═Na++H++SO42- | ||
| C. | MgCl2═Mg2++2Cl- | D. | Ba(OH)2═Ba2++2OH- |
分析 A.碳酸氢钠为强电解质,在溶液中电离出钠离子和碳酸氢根离子,碳酸氢根离子为多元弱酸碳酸的酸根离子,不能拆写;
B.NaHSO4是强酸强碱酸式盐,属强电解质,溶液中完全电离,电离出Na+、H+、SO42-离子;
C.氯化镁为盐,属于强电解质,完全电离出镁离子和氯离子;
D.氢氧化钡为强碱,完全电离出钡离子和氢氧根离子.
解答 解:A.碳酸氢根离子为多元弱酸碳酸的酸根离子,不能拆写,碳酸氢钠在水中电离出钠离子和碳酸氢根离子,电离方程式为NaHCO3═Na++HCO3-,故A错误;
B.硫酸氢钠属于二元强酸硫酸的酸式盐,能完全电离:NaHSO4=Na++H++SO42-,故B正确;
C.氯化镁为盐,属于强电解质,完全电离MgCl2═Mg2++2Cl-,故C正确;
D.氢氧化钡为强碱,完全电离Ba(OH)2═Ba2++2OH-,故D正确;
故选A.
点评 本题考查了电离方程式的书写正误判别,侧重基础知识的考查,题目难度不大,注意掌握强弱电解质的概念,明确电离方程式的书写方法,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
19.人们会利用纳米级(1-100nm,1nm=10-9m)微粒物质制造出更加优秀的材料和器件,使化学在材料、能源、环境和生命科学等领域发挥越来越重要的作用.将纳米级微粒物质溶解于液体溶剂中形成一种分散系,对该分散系及分散质颗粒的叙述中正确的是( )
| A. | 该分散系能发生丁达尔效应 | |
| B. | 该分散系为溶液 | |
| C. | 该分散系属于悬浊液 | |
| D. | 该分散系放置一段时间可能很快出现分层现象 |
16.能大量共存且溶液是无色的离子组合是( )
| A. | H+、Na+、CO32-、MnO4- | B. | Cu2+、K+、NO3-、SO42- | ||
| C. | K+、H+、NO3-、OH- | D. | Mg2+、Ca2+、Cl-、NO3- |
3.在某温度时,测得纯水中的[H+]=2.0×10-7 mol•L-1,则[OH-]为( )
| A. | 2.0×10-7 mol•L-1 | B. | 0.1×10-7 mol•L-1 | ||
| C. | 1.0×10-14/2.0×10-7 mol•L-1 | D. | 无法确定 |
13.如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
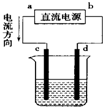

| A. | a为负极,b为正极 | B. | d为阳极,c为阴极 | ||
| C. | 电解过程中,d电极质量增加 | D. | 电解过程中,氯离子浓度不变 |
20.工业合成氨反应是700K左右进行的,这主要原因是( )
| A. | 700K时此反应速率最快 | |
| B. | 700K时氨的平衡浓度最大 | |
| C. | 700K时氨的转化率最高 | |
| D. | 700K该反应的催化剂能发挥最大的作用 |
17.下列事实中能说明亚硝酸是弱电解质的是( )
| A. | 用HNO2溶液做导电试验,灯光较暗 | |
| B. | HNO2是共价化合物 | |
| C. | 亚硝酸不与氯化钠反应 | |
| D. | 常温下0.1mol/L亚硝酸溶液的氢离子约为0.01mol/L |
18.少量的金属钠长期暴露在空气中,它的最终产物是( )
| A. | NaOH | B. | NaHCO3 | C. | Na2CO3 | D. | Na2CO3•10H2O |