题目内容
【题目】已知: ①CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1 ②H2(g)+1/2O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1下列说法正确的是( )
A. 常温常压时,燃烧1mol氢气放热为241.8 kJ
B. 由①可知,1 mol CO(g)和1/2mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用下图表示CO2(g)→CO(g)+![]() O2(g)反应是吸热反应
O2(g)反应是吸热反应

D. 生成1 mol H2O(g),其反应热为-241.8 kJ
【答案】BC
【解析】
A.常温常压下,1mol氢气完全燃烧生成液态水放出的热量才称为反应热,反应②中生成的水为气态,故A错误;
B.热化学方程式CO(g)+1/2O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1,表示1 mol CO(g)和1/2mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量,故B正确;
C.吸热反应是指反应物的总能量低于生成物, 可表示反应CO2(g)→CO(g)+O2(g)是吸热反应,故C正确;
可表示反应CO2(g)→CO(g)+O2(g)是吸热反应,故C正确;
D.分解1mol水需要吸收241.8KJ的热量,焓变为正值,故D错误;
故答案为BC。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】铅精矿可用于冶炼金属铅,其主要成分为PbS。
(1)火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为____________________________。
②火法炼铅的废气中含低浓度SO2,可将废气通入过量氨水中进行处理,反应的离子方程式为_____________________________________________________。
(2)湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如下:

已知:PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq) + 2Cl-(aq) ![]() PbCl42-(aq)
PbCl42-(aq)
不同温度下PbCl2的溶解度如下表所示:
温度(℃) | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.00 | 1.42 | 1.94 | 2.88 | 3.20 |
①浸取液中FeCl3的作用是________________________________。
②操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出,分析可能的原因是__________________________________________________________。
【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得列,化学方塑式为2NO(g) + Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡,继续通入Cl2,逆反应速率_____( 填增大、减少、不变).
(2)己知几种化学键的键能数据如下表( 亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl一Cl | Cl一N | N=O |
键能/kJ.mol-1 | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol,则a=_______。
2ClNO(g) △H=-111kJ/mol,则a=_______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1mol Cl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:
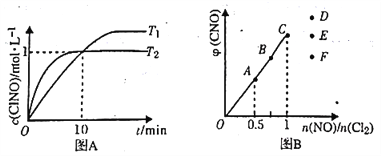
①该反应的△H_____0(填“>”“<”或“=”)。
②反应开始到10min 时NO 的平均反应速率v( NO) =________mol/(L.min).
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C 三状态中,NO 的转化率最大的是___点,当n(NO)/n(Cl2)=1.5时,达到平街状态ClNO 的体积分数可能是D、E、F三点中的______点。




