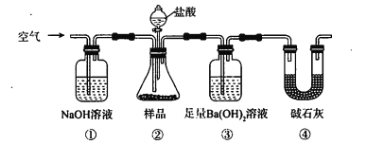
题目内容
【题目】双氧水(![]() )是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(
)是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(![]() ),该物质具有
),该物质具有![]() 与
与![]() 的双重性质。q请回答下列问题:
的双重性质。q请回答下列问题:
(1)写出![]() 的电子式:____________,并写出它与
的电子式:____________,并写出它与![]() 反应的化学方程式___________________________。
反应的化学方程式___________________________。
(2)若把![]() 看成二元弱酸,写出它在水中第一步电离的方程式__________。
看成二元弱酸,写出它在水中第一步电离的方程式__________。
(3)下列物质不会使过碳酸钠失效的是__________________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)稀![]() 不与Cu反应,但在稀
不与Cu反应,但在稀![]() 中加入
中加入![]() 后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目:_________________________。
后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目:_________________________。
【答案】![]() ; H2O2+SO2=H2SO4 H2O2
; H2O2+SO2=H2SO4 H2O2![]() H++HO2- B
H++HO2- B 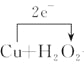 +H2SO4=CuSO4+2H2O
+H2SO4=CuSO4+2H2O
【解析】
(1)H2O2分子中有一个过氧键(—O—O—)和2个氢氧键(H—O),电子式为:![]() ,H2O2具有氧化性,SO2具有还原性,H2O2与SO2反应生成H2SO4,反应的化学方程式为H2O2+SO2=H2SO4,故答案为:
,H2O2具有氧化性,SO2具有还原性,H2O2与SO2反应生成H2SO4,反应的化学方程式为H2O2+SO2=H2SO4,故答案为:![]() ;H2O2+SO2=H2SO4;
;H2O2+SO2=H2SO4;
(2)双氧水可以可作是二元弱酸,说明双氧水分子能发生两步电离,其电离方程式为H2O2![]() H++HO2-、HO2-
H++HO2-、HO2-![]() H++O22-,故答案为:H2O2
H++O22-,故答案为:H2O2![]() H++HO2-、HO2-
H++HO2-、HO2-![]() H++O22-;
H++O22-;
(3)A、过氧化氢在二氧化锰的催化之下发生分解反应,所以会导致过碳酸钠晶体变质,故A错误;
B、NaHC03既不与过氧化氢(H2O2)反应也不与碳酸钠反应而变质,故B正确;
C、H2O2能氧化硫化氢生成单质硫,所以会导致过碳酸钠晶体变质,故C错误;
D、CH3COOH能与碳酸钠反应生成二氧化碳,所以会导致过碳酸钠晶体变质,故D错误;
故选B,故答案为:B;
(4)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:Cu+H2O2+2HCl=
CuCl2+2H2O,1molCu参与反应,转移电子数目为2mol,用单线桥标明电子转移的方向和数目如下: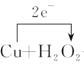 +H2SO4=CuSO4+2H2O,故答案为:
+H2SO4=CuSO4+2H2O,故答案为: +H2SO4=CuSO4+2H2O。
+H2SO4=CuSO4+2H2O。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】(题文)Ⅰ.某探究性学习小组用相同质量的锌和相同浓度的足量的稀硫酸反应得到实验数据如下表所示:
实验编号 | 锌的状态 | 反应温度/℃ | 收集100 mL氢气所需时间/s |
1 | 块状薄片 | 15 | 200 |
2 | 块状薄片 | 25 | 90 |
3 | 粉末 | 25 | 10 |
(1)该实验的目的是探究________、________对锌和稀硫酸反应速率的影响;
(2)实验1和2表明___________________________,化学反应速率越大;
(3)能表明固体的表面积对反应速率有影响的实验编号是________和_____________;
(4)请设计一个实验方案证明硫酸的浓度对该反应的速率的影响:_________________________。
Ⅱ.近年来,随着人们大量的开发使用,不但使得煤、石油、天然气的储量大大减少,而且直接燃烧化石燃料造成的环境污染问题,也是人类面临的重大挑战,如何实现化石燃料的综合利用,提高效率,减少污染提上了日程.
为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g) ![]() CH3OH(g),测定的部分实验数据如下:
CH3OH(g),测定的部分实验数据如下:
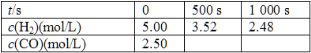
(1)在500 s内用H2表示的化学反应速率是__________________ mol/(L·S)。
(2)在1 000 s内用CO表示的化学反应速率是________ mol/(L·S), 1 000 s时CO的转化率是__________。
(3)在500 s时生成的甲醇的浓度是________ mol/L。