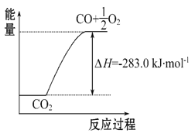
��Ŀ����
����Ŀ������A��B��C��D��E��F��G��Ԫ�����ڱ���ǰ18��Ԫ�أ����ǵ�ԭ��������������A��Eͬ������A��ԭ�Ӱ뾶��С��B��D��ɳ���������BD��BD2���Ҷ�����Է����������16�� F���������������ڵ��Ӳ�����G�����ǻ���ɫ���塣
��1��B��Ԫ�����ڱ��е�λ����__________��
��2��C2�ĵ���ʽΪ______��D��E��G��Ӧ�ļ����Ӱ뾶��С�����˳��Ϊ_______�������ӷ��ű�ʾ����
��3��д��һ��������֤��Ԫ��B��G�ķǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ____________��
��4�����������D��F��Ԫ����ɣ���������ס�C������B���ʰ����ʵ���֮��1��1��3��һ�������·�Ӧ�ɵõ��Һ�BD��д����Ӧ����ʽΪ________��
���𰸡��ڶ����ڵ�IVA��![]() r(Cl-)>r(O2-)>r��Na+��2HClO4+Na2CO3=CO2+H2O+2NaClO4Al2O3+N2+3C=2AlN+3CO
r(Cl-)>r(O2-)>r��Na+��2HClO4+Na2CO3=CO2+H2O+2NaClO4Al2O3+N2+3C=2AlN+3CO
��������
����A��B��C��D��E��F��G��Ԫ�����ڱ���ǰ18��Ԫ�أ����ǵ�ԭ��������������A��Eͬ������A��ԭ�Ӱ뾶��С����ǰ18��Ԫ���У�ԭ�Ӱ뾶��С��ΪH��B��D��ɳ���������BD��BD2���Ҷ�����Է����������16������D����Է�������Ϊ16������DΪOԪ�أ�F���������������ڵ��Ӳ�������ԭ����������16������FΪAlԪ�أ�G�����ǻ���ɫ���壬��GΪClԪ�أ�A��Eͬ���壬��EΪNaԪ�أ�BΪCԪ�أ�CΪNԪ�ء�
��1��������������֪��BΪCԪ�أ���Ԫ�����ڱ��е�λ�õڶ����ڵ�IVA�壻
��2��������������֪��CΪNԪ�أ�N2�ĵ���ʽΪ![]() �����Ӱ뾶�Ƚϵ��Ӳ���Խ�࣬�뾶Խ�����r(Cl-)>r(O2-)�� r(Cl-)>��Na+�������Ӳ�����ͬ���˵����Խ��뾶ԽС�����r(O2-)>r��Na+���������������Ӱ뾶��СΪr(Cl-)>r(O2-)>r��Na+����
�����Ӱ뾶�Ƚϵ��Ӳ���Խ�࣬�뾶Խ�����r(Cl-)>r(O2-)�� r(Cl-)>��Na+�������Ӳ�����ͬ���˵����Խ��뾶ԽС�����r(O2-)>r��Na+���������������Ӱ뾶��СΪr(Cl-)>r(O2-)>r��Na+����
��3��Ԫ������������Ӧˮ���������Խǿ������ǽ�����Խǿ�������ݻ�ѧ��Ӧ���ɣ�ǿ������Ʊ����ᣬ����2HClO4+Na2CO3=CO2+H2O+2NaClO4����֤��Cl�ķǽ�����ǿ��C��
��4�����������D��F��Ԫ����ɣ����Ի������Ϊ�������� C����Ϊ������ B����Ϊ̼�����߰����ʵ���֮��1��1��3��һ�������·�Ӧ�ɵõ��Һ�һ����̼�����������غ��֪��Ϊ����������Ӧ����ʽΪAl2O3+N2+3C=2AlN+3CO��

����Ŀ�����й���ǿ������ʼ��ǵ���ʵ��ж���ȫ��ȷ����
ѡ�� | A | B | C | D |
ǿ����� | NaCl | CaCl2 | HNO3 | H2SO4 |
������� | CH3COOH | BaSO4 | AlCl3 | HF |
�ǵ���� | Cl2 | CO2 | SO2 | C2H5OH |
A.AB.BC.CD.D