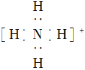题目内容
【题目】黄色超氧化钾(![]() )可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究
)可作为宇宙飞船舱的氧源。某学习小组设计以下实验探究![]() 的性质,请回答相关问题:
的性质,请回答相关问题:
Ⅰ.探究![]() 与水的反应:取少量
与水的反应:取少量![]() 固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加
固体于试管中,滴加少量水快速产生气泡,将带火星的木条靠近试管口木条复燃;滴加酚酞试液,溶液先变红后褪色。向褪色后溶液中滴加![]() 溶液,产生的现象为____________________________________。
溶液,产生的现象为____________________________________。
Ⅱ.探究![]() 与
与![]() 的反应:
的反应:
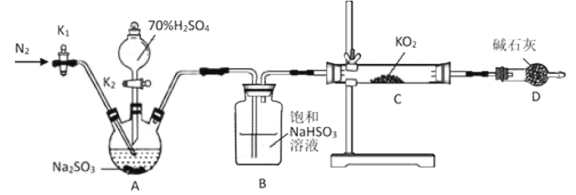
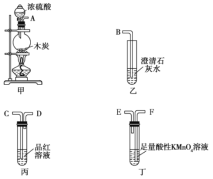
(1)检查上述装置气密性的方法是__________________________________。
(2)正确的操作依次是_________________________。(操作可重复选择)
①打开![]() 通入
通入![]() ,并维持一段时间后关闭 ②实验完成,拆卸装置 ③检查装置气密性,然后装入药品 ④打开分液漏斗活塞
,并维持一段时间后关闭 ②实验完成,拆卸装置 ③检查装置气密性,然后装入药品 ④打开分液漏斗活塞![]()
(3)A装置发生反应的化学方程式为________________________。
(4)用上述装置验证“![]() 与
与![]() 反应生成
反应生成![]() ”还存在不足,你的改进措施是___________________。
”还存在不足,你的改进措施是___________________。
(5)改进后再实验,待![]() 完全反应后,将装置C中固体加水溶解,配成
完全反应后,将装置C中固体加水溶解,配成![]() 溶液,等分为
溶液,等分为![]() 两份。
两份。
①向M溶液中加入足量的盐酸酸化的![]() 溶液,充分反应后,将沉淀过滤、_______、________,称重为4.66g。
溶液,充分反应后,将沉淀过滤、_______、________,称重为4.66g。
②将N溶液移入锥形瓶中,用![]() 酸性
酸性![]() 溶液滴定,当出现_______________现象时,达到滴定终点,此时消耗酸性
溶液滴定,当出现_______________现象时,达到滴定终点,此时消耗酸性![]() 溶液
溶液![]() 。
。
③依据上述现象和数据,请写出装置C中总反应的化学方程式___________。
【答案】有红褐色沉淀和气泡产生 在装置末端连接--导管并将导管末端插入水中,关闭![]() 和
和![]() ,微热A,若导管末端有气泡产生,(冷却后导管中形成一段水柱)则说明气密性良好 ③①④①②
,微热A,若导管末端有气泡产生,(冷却后导管中形成一段水柱)则说明气密性良好 ③①④①② ![]() 在
在![]() 之间连接一个盛有浓硫酸的洗气瓶 洗涤 干燥 锥形瓶中溶液由无色变为微红色,且半分钟(
之间连接一个盛有浓硫酸的洗气瓶 洗涤 干燥 锥形瓶中溶液由无色变为微红色,且半分钟(![]() )内不褪色
)内不褪色 ![]()
【解析】
根据实验原理及实验装置分析实验现象及操作方法;根据氧化还原反应原理及滴定原理分析解答。
Ⅰ. 过氧化钾和水反应生成氢氧化钾和氧气,滴入酚酞试液变红色,随后褪去,说明反应过程中生成过氧化氢,滴加FeCl3溶液,会和氢氧化钠溶液反应生成氢氧化铁红褐色沉淀,同时铁离子催化过氧化氢分解生成氧气,反应现象是:产生红褐色沉淀和气体,故答案为:产生红褐色沉淀和气体;
Ⅱ.(1)根据实验装置的特点,检查气密性的方法为:在装置末端连接一导管并将导管末端插入水中,关闭![]() 和
和![]() ,微热A,若导管末端有气泡产生,(冷却后导管中形成一段水柱)则说明气密性良好,故答案为:在装置末端连接一导管并将导管末端插入水中,关闭
,微热A,若导管末端有气泡产生,(冷却后导管中形成一段水柱)则说明气密性良好,故答案为:在装置末端连接一导管并将导管末端插入水中,关闭![]() 和
和![]() ,微热A,若导管末端有气泡产生,(冷却后导管中形成一段水柱)则说明气密性良好;
,微热A,若导管末端有气泡产生,(冷却后导管中形成一段水柱)则说明气密性良好;
(2)探究KO2与SO2的反应,分析装置可知,操作步骤为:检查装置气密性,然后装入药品,打开K1通入![]() ,排尽装置内原气体后关闭,打开分液漏斗活塞K2,使浓硫酸和亚硫酸钠反应生成二氧化硫气体,打开K1通入N2,把生成的二氧化硫赶出到B中吸收,实验完成,拆卸装置,正确的操作顺序为:③①④①②;故答案为:③①④①②;
,排尽装置内原气体后关闭,打开分液漏斗活塞K2,使浓硫酸和亚硫酸钠反应生成二氧化硫气体,打开K1通入N2,把生成的二氧化硫赶出到B中吸收,实验完成,拆卸装置,正确的操作顺序为:③①④①②;故答案为:③①④①②;
(3)A装置中是浓硫酸和亚硫酸钠反应生成二氧化硫的反应,化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)用上述装置验证“KO2与SO2反应生成O2”还存在不足,气体中的水蒸气和过氧化钾也能反应生成氧气,不能判断二氧化硫是否反应生成氧气,需要改进的措施是:在![]() 之间连接一个盛有浓硫酸的洗气瓶,故答案为:在
之间连接一个盛有浓硫酸的洗气瓶,故答案为:在![]() 之间连接一个盛有浓硫酸的洗气瓶;
之间连接一个盛有浓硫酸的洗气瓶;
(5)①向M溶液中加入足量的盐酸酸化的BaCl2溶液,充分反应后,将沉淀过滤、洗涤、干燥称重,故答案为:洗涤;干燥;
②用酸性高锰酸钾滴定时,达到滴定终点的现象为:锥形瓶中溶液由无色变为微红色,且半分钟(![]() )内不褪色,故答案为:锥形瓶中溶液由无色变为微红色,且半分钟(
)内不褪色,故答案为:锥形瓶中溶液由无色变为微红色,且半分钟(![]() )内不褪色;
)内不褪色;
③将沉淀过滤、洗涤、干燥称重为4.66g,得到硫酸钡沉淀, n(BaSO4)=![]() =0.02mol;用0.20mol/L酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液20.00mL,说明反应产物中还有亚硫酸钾,物质的量结合反应定量关系和电子守恒计算,2KMnO45K2SO310e,亚硫酸钾物质的量=0.2mol/L×0.020L×
=0.02mol;用0.20mol/L酸性KMnO4溶液滴定,终点时消耗酸性KMnO4溶液20.00mL,说明反应产物中还有亚硫酸钾,物质的量结合反应定量关系和电子守恒计算,2KMnO45K2SO310e,亚硫酸钾物质的量=0.2mol/L×0.020L×![]() =0.01mol;则生成的硫酸钾与亚硫酸钾物质的量之比为0.01mol:0.02mol=1:2,根据原子守恒及得失电子守恒书写并配平得到化学方程式:
=0.01mol;则生成的硫酸钾与亚硫酸钾物质的量之比为0.01mol:0.02mol=1:2,根据原子守恒及得失电子守恒书写并配平得到化学方程式:![]() ,故答案为:
,故答案为:![]() 。
。

 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案