题目内容
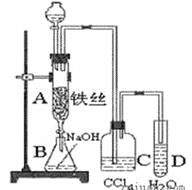
【题目】某校高一学生学完胶体后,在老师的指导下,有甲、乙、丙三名同学分别进行Fe(OH)3 胶体的制备实验。
甲同学向 1 mol·L-1氯化铁溶液中加入少量的NaOH 溶液; 乙同学直接加热饱和FeCl3 溶液;
丙同学向 25 mL 沸水中逐滴加入 1 mL~2 mL FeCl3 饱和溶液,继续煮沸至溶液呈红褐色, 停止加热。试回答下列问题:
(1)其中操作正确的同学是________;若丙同学实验中不停止加热,会看到 __________。
(2)丁同学利用所制得的Fe(OH)3 胶体进行下列实验:
①将其装入 U 形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明___。
②向其中逐滴加入稀硫酸至过量,观察到的实验现象是________。
【答案】丙 红褐色沉淀生成 氢氧化铁胶体粒子带正电荷 先有红褐色沉淀生成然后溶解或先有沉淀生成然后溶解
【解析】
根据制备氢氧化铁胶体的方法进行判断;根据胶体的性质具有丁达尔效应、聚沉进行判断。
(1)制备氢氧化铁胶体:向沸水中滴加饱和FeCl3溶液,继续加热直至出现红褐色液体为止,即得氢氧化铁胶体,因此丙同学的操作正确;胶体具有聚沉的性质,其中使胶体聚沉的方法之一是加热,因此丙同学实验中不停止加热会看到红褐色沉淀产生;
(2)①因为氢氧化铁显红褐色,阴极附近颜色逐渐变深,说明氢氧化铁胶粒向阴极移动,根据同电相斥异电相吸的原则,说明氢氧化铁胶粒带正电;
②硫酸是电解质,会造成胶体的聚沉,因此先看到有红褐色沉淀产生,然后氢氧化铁和硫酸发生中和反应生成硫酸铁,即后观察到沉淀消失,溶液显黄色。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】通过简单地推理或计算填空。
(1)X原子有两个电子层,K 层电子数是L层电子数的一半,X是_______(写元素符号)元素。
(2)若某元素形成的简单离子的电子层数和最外层电子数与 Ne原子相同,其可能的离子中半径最小的是__________(填离子符号)。
(3)元素R能够与某非金属元素 W 形成化合物 RWn,已知 RWn 分子中各原子核外最外层电子总数为26,核外电子数总和为66 ,则 W 是 ___________(写元素符号)元素,n=_____________。
(4)位于三个不同周期的四种短周期主族元素 A、B、C、D,其部分元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 其单质是密度最小的物质 |
B | 阴离子带两个单位负电荷,其单质是空气的主要成分之一 |
C | 在短周期主族元素中金属性最强 |
D | 最高价氧化物对应水化物的酸性最强 |
①写出常温下D的单质与A、B、C形成的化合物的稀溶液反应的化学方程式:________________。
②D的最高价氧化物对应的水化物与 A、B、C形成的化合物的水溶液反应的离子方程式为________________________。