题目内容
【题目】消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
则常温常压下,NH3与NO2反应生成无污染物质的热化学方程式_____________。
(2)水体中过量氨氮(以NH3表示)会导致水体富营养化。
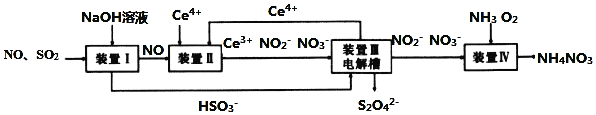
①用次氯酸钠除去氨氮的原理如图所示:

写出该图示的总反应化学方程式:__________________。该反应需控制温度,温度过高时氨氮去除率降低的主要原因是______________。
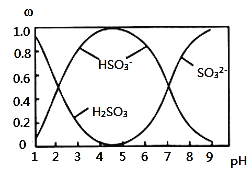
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图所示:

当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是___。
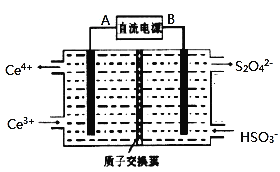
(3)电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2,工作原理如图所示:

①写出该活性原子与NO3-反应的离子方程式:________________。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为____mol。
【答案】8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) ΔH=(2c-7a-3b)kJ·mol-1 2NH3+3NaClO=N2+3NaCl+3H2O 温度过高,HClO发生分解,氨氮去除率随之降低 有部分NH3被氧化成NO2—或NO3— 2NO3—+10H+=N2↑+2OH—+4H2O 0.08
【解析】
(1)已知:已知:N2(g)+O2(g)=2NO(g) ΔH=a kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
根据盖斯定律得③×27×①3×②得到反应8NH3(g)+6NO2(g)═7N2(g)+12H2O(l) △H=(2c7a3b) kJ·mol![]() ,
,
故答案为:8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) ΔH=(2c-7a-3b)kJ·mol-1;
(2)①根据图示,由始态和终态判断反应物中NH3被氧化为N2,则NaClO被还原为NaCl,生成1molN2转移6mol电子,根据转移电子守恒需要3molNaClO,再结合元素守恒,写出化学方程式2NH3+3NaClO=N2↑+3NaCl+3H2O;温度对化学反应速率有影响,温度越高,化学反应率越快。所以温度低时,去除率低的原因是反应速率慢,HClO不稳定,易分解,温度高时,加快了HClO的分解速率,从而使去除率降低,
故答案为:2NH3+3NaClO=N2↑+3NaCl+3H2O ;温度过高,HClO发生分解,氨氮去除率随之降低;
②当m(NaClO)∶m(NH3)>7.6时,总氮的去除率随m(NaClO):m(NH3)的增大不升反降的原因是:NaClO投入过多会将部分NH3氧化为NO2—或NO3—等更高价态的物质,未能从溶液中除去,
故答案为:有部分NH3被氧化成NO2—或NO3—;
(3)①活性原子与NO3—反应是电解过程中生成的氢离子还原硝酸根离子生成氮气,反应的离子方程式:2NO3—+10H+=N2↑+2OH—+4H2O,
故答案为:2NO3—+10H+=N2↑+2OH—+4H2O;
②若阳极生成标准状况下2.24L气体,则此气体为氢氧根离子失电子生成的氧气,其物质的量=![]() ,由2NO3—+10H+=N2↑+2OH—+4H2O 可知,2NO3—N2↑10e2.5O2,电子守恒计算得到理论上可除去NO3—的物质的量为0.08mol,
,由2NO3—+10H+=N2↑+2OH—+4H2O 可知,2NO3—N2↑10e2.5O2,电子守恒计算得到理论上可除去NO3—的物质的量为0.08mol,
故答案为:0.08。

【题目】在体积为2L的恒容密闭容器中加入![]() 和一定量的CO后,发生反应:
和一定量的CO后,发生反应:![]() ,CO和
,CO和![]()
![]() 的物质的量随时间的变化如下表表示:则下列说法错误的是( )
的物质的量随时间的变化如下表表示:则下列说法错误的是( )
| 0 | 3 | 10 | 12 |
| 2 | 1 |
|
|
| 0 | 1 |
|
|
A.在![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.在该条件下,上述反应的平衡常数为3
C.反应达平衡时,![]()
![]() 的体积分数为
的体积分数为![]()
D.要增大反应速率且增大![]()
![]() 在混合物中的体积分数,可采用压缩体积,增大体系压强的措施
在混合物中的体积分数,可采用压缩体积,增大体系压强的措施
【题目】以菱镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]()
![]() 为原料制备高纯氧化镁的实验流程如下:
为原料制备高纯氧化镁的实验流程如下:

![]() 滤液P中含有的阳离子有 ______。
滤液P中含有的阳离子有 ______。
![]() 过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
![]() 已知:
已知:
|
|
| |
开始沉淀的pH |
|
|
|
沉淀完全的pH |
|
|
|
过程Ⅲ中加入![]() 调节溶液pH约为4,其目的是 ______ 。
调节溶液pH约为4,其目的是 ______ 。
![]() 过程Ⅳ在
过程Ⅳ在![]() 煅烧
煅烧![]() ,发生多个反应,产物除MgO外,还有
,发生多个反应,产物除MgO外,还有![]() 、
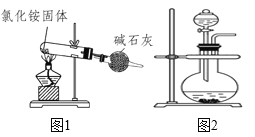
、![]() 、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
![]() 中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
![]() 中盛放的溶液是
中盛放的溶液是![]() 填字母
填字母![]() ______ 。
______ 。
![]() 溶液
溶液![]() 溶液
溶液 ![]() 稀硝酸
稀硝酸![]() 溶液
溶液
![]() 写出
写出![]() 煅烧
煅烧![]() ,产生气体产物是S和CO的化学方程式 ______ 。
,产生气体产物是S和CO的化学方程式 ______ 。
【题目】用如图所示装置检验乙烯时不需要除杂的是( )
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | 溴水 |
C | CH3CH2OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |

A.AB.BC.CD.D