题目内容
【题目】用如图所示装置检验乙烯时不需要除杂的是( )
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | 溴水 |
C | CH3CH2OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4加热至170℃ | NaOH溶液 | 溴水 |

A.AB.BC.CD.D
【答案】B
【解析】
A.CH3CH2Br与NaOH乙醇溶液共热制备的乙烯中含有乙醇,乙烯和乙醇都能使KMnO4酸性溶液褪色;
B.CH3CH2Br与NaOH乙醇溶液共热制备的乙烯中含有乙醇,乙醇不与溴水反应;
C.乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,二氧化硫、乙醇能与KMnO4酸性溶液反应,SO2中+4价S具有还原性,能还原酸性KMnO4溶液,使其紫色褪去,乙醇也能被KMnO4酸性溶液氧化;
D.乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,二氧化硫能与溴水反应使其褪色。
A.溴乙烷的消去反应: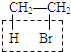 +NaOH
+NaOH![]() CH2=CH2↑+NaBr+H2O,利用KMnO4+CH2═CH2+H2SO4→CO2↑+K2SO4+MnSO4+H2O,导致酸性KMnO4溶液褪色,检验乙烯;但乙烯中含有杂质乙醇,乙醇能与KMnO4酸性溶液反应,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4,使KMnO4酸性溶液褪色,故需用水除杂,乙醇能和水任意比互溶,而乙烯难溶于水,选项A正确;
CH2=CH2↑+NaBr+H2O,利用KMnO4+CH2═CH2+H2SO4→CO2↑+K2SO4+MnSO4+H2O,导致酸性KMnO4溶液褪色,检验乙烯;但乙烯中含有杂质乙醇,乙醇能与KMnO4酸性溶液反应,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4,使KMnO4酸性溶液褪色,故需用水除杂,乙醇能和水任意比互溶,而乙烯难溶于水,选项A正确;
B.乙醇易挥发,CH3CH2Br与NaOH乙醇溶液共热: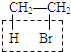 +NaOH
+NaOH![]() CH2=CH2↑+NaBr+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,乙烯中含有的杂质是乙醇,乙醇不与溴水反应,故无需除杂,选项B错误;
CH2=CH2↑+NaBr+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,乙烯中含有的杂质是乙醇,乙醇不与溴水反应,故无需除杂,选项B错误;
C.乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,CH3-CH2-OH ![]() CH2═CH2↑+H2O,同时乙醇和浓硫酸还能发生氧化反应生成二氧化硫气体,故乙烯中含有的杂质有乙醇、二氧化硫、二氧化碳等,二氧化硫、乙醇能与KMnO4酸性溶液反应,2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,导致酸性KMnO4溶液褪色,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4,使KMnO4酸性溶液褪色,故需用NaOH溶液吸收二氧化硫,NaOH溶液也能溶解乙醇,选项C正确;
CH2═CH2↑+H2O,同时乙醇和浓硫酸还能发生氧化反应生成二氧化硫气体,故乙烯中含有的杂质有乙醇、二氧化硫、二氧化碳等,二氧化硫、乙醇能与KMnO4酸性溶液反应,2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4,导致酸性KMnO4溶液褪色,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4,使KMnO4酸性溶液褪色,故需用NaOH溶液吸收二氧化硫,NaOH溶液也能溶解乙醇,选项C正确;
D.乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,CH3-CH2-OH ![]() CH2═CH2↑+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,同时乙醇和浓硫酸还能发生氧化反应,生成二氧化硫气体,乙烯中含有的杂质有乙醇、二氧化硫、二氧化碳等,二氧化硫能与溴水反应,SO2+2H2O+Br2═H2SO4+2HBr,乙醇与水互溶,二氧化碳不影响乙烯的检验,需要用氢氧化钠除去二氧化硫,故D正确;
CH2═CH2↑+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,同时乙醇和浓硫酸还能发生氧化反应,生成二氧化硫气体,乙烯中含有的杂质有乙醇、二氧化硫、二氧化碳等,二氧化硫能与溴水反应,SO2+2H2O+Br2═H2SO4+2HBr,乙醇与水互溶,二氧化碳不影响乙烯的检验,需要用氢氧化钠除去二氧化硫,故D正确;
答案选B。

【题目】探究2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:
实验 编号 | 温度 (℃) | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4 溶液褪色平均时间(min) | ||
体积 (mL) | 浓度 (mol·L-1) | 体积 (mL) | 浓度 (mol·L-1) | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈6.6×l0-3mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢