题目内容
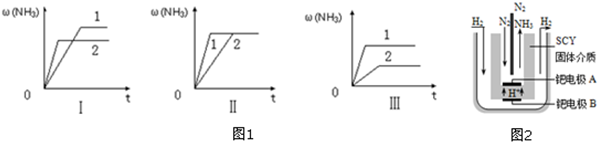
2.Ⅰ.若甲同学利用下列装置验证木炭与浓硫酸反应的全部产物
(1)写出木炭与浓硫酸反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(2)A中加入的试剂是无水CuSO4粉末,B、D中加入的试剂都是品红溶液,B装置的作用是检验二氧化硫的存在,D中正确的实验现象是:品红不褪色.
(3)C的作用是除去二氧化硫.
(4)E装置的作用是检验二氧化碳的存在,其中的化学反应的方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.
Ⅱ.若乙同学只用B、C、D、E装置验证SO2的某些性质,请回答下列问题:
(1)C中加入的试剂是品红溶液,证明SO2具有漂白性.
(2)D中加入酸性的KmnO4溶液,证明SO2具有还原性.
(3)E中加入滴有酚酞的NaOH溶液,证明SO2是酸性气体.
分析 Ⅰ.(1)碳与浓硫酸在加热条件下反应生成二氧化碳、二氧化硫和水,据此写出反应的化学方程式;
(2)反应有二氧化硫、二氧化碳和水,完了避免干扰,应该先用无水硫酸铜具有水,然后用品红溶液检验二氧化硫,再用酸性高锰酸钾溶液除去二氧化硫、用品红溶液检验二氧化硫已经除尽,最后用澄清石灰水检验二氧化碳;
(3)装置C中盛放的是酸性高锰酸钾溶液,用于除去二氧化硫;
(4)E是用于检验二氧化碳的,盛放的是澄清石灰水;
Ⅱ.(1)二氧化硫检验漂白性,能够使品红溶液褪色;
(2)酸性高锰酸钾溶液具有强氧化性,能够将二氧化硫氧化成硫酸,根据化合价变化分析二氧化硫的性质;
(3)二氧化硫为酸性氧化物,能够与氢氧化钠溶液反应,则二氧化硫通入滴有酚酞的NaOH溶液后溶液褪色.
解答 解:Ⅰ.(1)碳与浓硫酸在加热条件下反应的方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)由于溶液中含有水,要检验反应产物,必须先检验水,使用试剂为无水CuSO4粉末;二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,所以应该先检验二氧化硫,然后将二氧化硫除尽,最后检验二氧化碳,所以B中品红溶液褪色,证明了二氧化硫存在;D中品红溶液褪色,证明二氧化硫已经除尽,
故答案为:无水CuSO4粉末;检验二氧化硫的存在;品红不褪色;
(3)二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,所以应该先将二氧化硫除尽,再检验二氧化碳,装置C中盛放的是酸性高锰酸钾,用于除去二氧化硫,
故答案为:除去二氧化硫;
(4)D中品红溶液不褪色,证明二氧化硫已经除尽,则D用于检验二氧化碳,盛放的是澄清石灰水,如果澄清石灰水变浑浊,则证明产物中有二氧化碳,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,
故答案为:检验二氧化碳的存在;Ca(OH)2+CO2═CaCO3↓+H2O;
Ⅱ.(1)装置C盛放的是品红溶液,品红溶液褪色,则证明混合气体中含有二氧化硫,故答案为:品红溶液;
(2)二氧化硫中S的化合价为+4价,能够被强氧化剂酸性高锰酸钾溶液氧化成+6价,反应中二氧化硫表现了还原性,故答案为:还原;
(3)E中加入滴有酚酞的NaOH溶液,溶液会褪色,证明二氧化硫能够与氢氧化钠溶液反应,则二氧化硫为酸性氧化物,故答案为:酸.
点评 本题考查了浓硫酸的性质、常见气体的性质及检验,题目难度中等,注意掌握浓硫酸的化学性质,明确气体的性质及检验的先后顺序为解答关键,试题有利于提高学生的化学实验能力.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案①混合气体的密度
②容器内气体的压强
③混合气体总物质的量
④B物质的量浓度.
| A. | ①④ | B. | 只有②③ | C. | ②③④ | D. | 只有④ |
| A. | 在元素周期表中,铝的周期数是其主族序数的2倍 | |
| B. | 铝原子的基态电子排布图为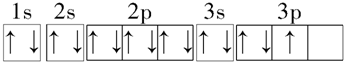 | |
| C. | 同周期,铝、钙所在主族的元素的原子序数之差只为1或11 | |
| D. | 工业上冶炼金属铝的方法是电解熔融的Al2O3 |
| A. | CH3CH2Br+NaHS→CH3CH2SH+NaBr | |
| B. | CH3I+CH3ONa→CH3OCH3+NaI | |
| C. | CH3CH2Cl+CH3ONa→CH3CH2ONa+CH3Cl | |
| D. | CH3CH2Cl+CH3CH2ONa→(CH3CH2)2O+NaCl |
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在锥形瓶,滴加2滴酚酞作指示剂.把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数.实验重复3次.记录见下表.
| 滴定次数 | NaOH溶液体积/mL | 滴定消耗滤液体积/mL |
| 1 | 25.00 | 20.02 |
| 2 | 25.00 | 17.10 |
| 3 | 25.00 | 19.98 |
(2)配制成250mL溶液使用的量具是250mL容量瓶;
(3)滴定终点的现象是浅红色溶液变为无色,半分钟内不变色.
(4)滤液中溶质的物质的量浓度为0.125mol•L-1.
(5)若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果偏高. (填“偏高”、“偏低”或“无影响”)
| A. | 动物油加入稀硫酸生产肥皂 | |
| B. | 天然气、液化石油气的成分相同 | |
| C. | 乙烯和乙醛都能发生加成反应 | |
| D. | 石油裂解和蔗糖水解都是由高分子生成小分子的过程 |
| A. | 用含有铁粉的透气小袋与食品一起密封包装,说明铁粉能吸收水分 | |
| B. | 浓硫酸可以盛放在铝桶中,说明铝不能与浓硫酸反应 | |
| C. | 硫酸铝与碳酸氢钠能制作泡沫灭火剂,利用了硫酸铝溶液与碳酸氢钠溶液混合后能发生剧烈双水解反应 | |
| D. | 用氢氟酸雕刻玻璃,说明氢氟酸是强酸 |

 .
. ;,反应类型是加聚反应.
;,反应类型是加聚反应.