题目内容
5.乙烯是石油裂解气的主要成分,其产量通常用于衡量一个国家石油化工发展水平.请回答下列问题.(1)下列物质中,不可以通过乙烯发生加成反应得到的是B(填序号).
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(2)下列能鉴别甲烷和乙烯的试剂是BD.(填序号)
A.稀盐酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)已知2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.若以乙烯为主要原料合成乙酸,其合成路线如下所示:
乙烯$\stackrel{Ⅰ}{→}$A$\stackrel{Ⅱ}{→}$B$\stackrel{Ⅲ}{→}$乙酸
①A物质和乙酸的官能团的名称分别为羟基、羧基;
②反应Ⅱ的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,A和乙酸反应的化学方程式为:CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.
CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.
分析 (1)乙烯含有碳碳双键,在一定条件下可与氢气、水、氯化氢等发生加成反应;
(2)乙烯含有碳碳双键,可与溴发生加成反应,被酸性高锰酸钾氧化;
(3)由转化关系可知A为乙醇,B为乙醛,以此解答该题.
解答 解:(1)乙烯和溴化氢发生加成生成溴乙烷,和水加成生成乙醇,和氢气加成生成乙烷,但与氯气反应生成1,2-二氯乙烷,故答案为:B;
(2)乙烯含有碳碳双键,可与溴发生加成反应,被酸性高锰酸钾氧化,则可使溴的四氯化碳溶液或酸性高锰酸钾溶液褪色,可鉴别,故答案为:BD;
(3)由转化关系可知A为乙醇,B为乙醛,
①A为乙醇,含有羟基,乙酸含有羧基,故答案为:羟基;羧基;
②反应Ⅱ为乙醇的催化氧化反应,方程式为乙醇的催化氧化反应为2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O;CH3COOH+CH3CH2OH CH3COOC2H5+H2O;取代或酯化反应.
CH3COOC2H5+H2O;取代或酯化反应.
点评 本题考查有机物的推断,侧重于学生的分析能力的考查,为高频考点,本题着重于乙烯的考查,注意把握乙烯的性质以及用途,难度不大.

练习册系列答案
相关题目
15.空气冷却分离是工业上制取大量氮气的主要方法.已知空气各主要成分的沸点如表:
若将空气深度冷却液化,然后缓慢升温,沸腾分离,则最先分离出来的气体是( )
| 气体 | N2 | O2 | Ar | CO2 |
| 沸点 | -196℃ | -183℃ | -186℃ | -78℃ |
| A. | O2 | B. | N2 | C. | Ar | D. | CO2 |
16.如图表示a~g七种烃分子中4个碳原子相互结合的方式.小球表示碳原子,小棍表示化学键,碳原子上其余的化学键都是与氢结合.下列说法正确的是( )


| A. | 只含4个碳原子的烃中,碳原子间的相互结合方式共有如图所示七种情况 | |
| B. | 以上七种物质均属于烷烃 | |
| C. | c和f分子的空间构型相同 | |
| D. | d与g互为同分异构体 |
13.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:C2H4 | |
| B. | 水的电子式: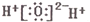 | |
| C. | 氯离子的结构示意图: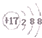 | |
| D. | 中子数为146,质子数为92的铀(U)原${\;}_{92}^{146}$U |
20.下列有关元素周期表和元素周期律的说法不正确的是( )
| A. | 从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 | |
| B. | 从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 | |
| C. | 等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 | |
| D. | 氧和硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
10.实验室中准备有以下主要仪器及用品,大试管、带导管的单孔塞、药匙、镊子、水槽、集气瓶、玻璃片、酒精灯、铁架台,如果药品选用合理,用以上仪器用品,能完成的实验有( )
| A. | 制取一氧化氮 | B. | 制取乙烯 | C. | 制取乙炔 | D. | 氢气还原氧化铜 |
17.松节油结构如图所示,在浓硫酸、加热条件下发生消去反应,最多可以生成几种有机产物( )
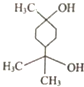

| A. | 4种 | B. | 5种 | C. | 8种 | D. | 9种 |
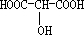 ;
;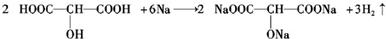 ;
;
 .
.