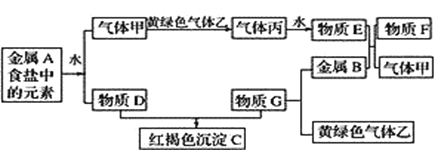
题目内容
【题目】二元化合物X呈黑棕色晶体,易潮解,易溶于水、乙醇和乙醚;熔点306℃,沸点315℃,400℃时存在二聚体。将X加热到200℃以上释放出一种单质气体:取1.2000 g X,加热完全分解为晶体B和气体C;气体C用足量KI溶液吸收,再用0.2500 mol/L Na2S2O3溶液进行滴定,消耗29.59 mL;晶体B可溶于水,所得溶液用0.0500 mol/L的K2Cr2O7溶液进行滴定,消耗24.66 mL。设分解反应转移电子数为n,则X的摩尔质量为___________;满足条件的X是___________。
【答案】162.5 g/mol FeCl3
【解析】
由X的物理性质知X易升华,是分子晶体。加热分解时发生氧化还原反应,气体C用足量KI溶液吸收,再用0.2500 mol/L Na2S2O3溶液进行滴定,晶体B的溶液用0.0500 mol/L的K2Cr2O7溶液进行滴定,两个过程电子转移量相等。X的质量是两元素质量之和,两种元素物质的量之比等于化学式中原子个数之比。
气体C用足量KI溶液吸收,再用0.2500 mol/L Na2S2O3溶液进行滴定,反应时C中元素化合价降低,KI被氧化为I2,I2再被Na2S2O3还原为I-,符合此条件的单质为氯气,所以X中含氯元素;X分解得到B,所得溶液用0.0500 mol/L的K2Cr2O7溶液滴定,Cr元素被还原,B中元素被氧化,溶液中有变价的金属元素是铁元素,所以X中含铁元素,X中含铁、氯两种元素。由电子守恒得关系式:6Fe2+~ K2Cr2O7, n(Fe2+)=6n(K2Cr2O7)=6![]() 24.66 mL
24.66 mL![]() —3L/ml,m(Fe2+)= n(Fe2+)
—3L/ml,m(Fe2+)= n(Fe2+)![]() ,
,
n(Cl-)=m (Cl-)/M (Cl-)=[1.2- m(Fe)]/ M (Cl-),n(Fe): n(Cl)=1:3,所以X化学式为FeCl3,,所以摩尔质量为162.5 g/mol,
故答案为162.5 g/mol ;FeCl3。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案