题目内容
【题目】结合氯气的相关知识解决下列问题。
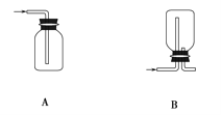
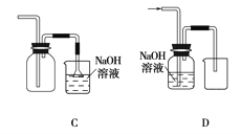
(1)在实验室中制取Cl2,下列收集Cl2的装置中正确的是_______(填字母)。
漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同,漂白粉与稀盐酸发生复分解反应以增强漂白性,化学方程式为_________。漂白粉与浓盐酸发生氧化还原反应会生成氯气,化学方程式为____________。
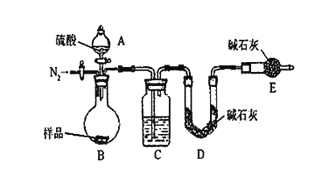
(2)图1是某同学制备氯水的装置图。
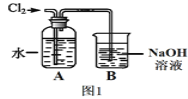
①装置B中发生反应的化学方程式为__________________。
②检验一瓶氯水是否已经完全变质,可选用的试剂是______________(填序号)。
A.硝酸银溶液B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
③氯水久置变质的主要反应方程式表示为______________________。
(3)已知氧化性:Br2>Fe3+。若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______(填离子符号)。
【答案】C Ca(ClO)2 +2HCl =CaCl2 +2HClO Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O Cl2+2NaOH=NaCl+NaClO+H2O D 2HClO![]() 2HCl+O2↑ Fe2+
2HCl+O2↑ Fe2+
【解析】
(1)依据氯气密度大于空气密度,可溶于水的有毒气体的物理性质选择正确的收集方法;依据强酸制备弱酸规律,盐酸与次氯酸钙反应生成氯化钙和次氯酸;
漂白粉与浓盐酸发生氧化还原反应生成氯气、氯化钙和水;
(2)①装置B中发生反应是氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
②氯水中HClO不稳定,若变质生成盐酸,酸性增强;
(3)利用谁强谁先反应规律进行分析。
(1)A.只有进气口,没有出气口,无法排出气体,故A错误;
B. 此装置是用来收集比空气轻的气体,若收集氯气,应选择向上排空气法,需要短进长出,故B错误;
C. 装置长进短出可以收集比空气重的气体氯气,剩余的氯气有毒需要用氢氧化钠溶液吸收,为防止倒吸,用倒扣在水面的漏斗,符合要求,故C正确;
D. 氯气通入NaOH溶液会发生反应。氯气被氢氧化钠吸收,不能收集到氯气,故D错误;
故选:C;
盐酸与次氯酸钙反应生成氯化钙和次氯酸,反应的化学方程式:Ca(ClO)2 +2HCl =CaCl2 +2HClO;
漂白粉与浓盐酸发生氧化还原反应生成氯气、氯化钙和水,化学方程式:Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O;
故答案为:Ca(ClO)2 +2HCl =CaCl2 +2HClO;Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O;
(2)①装置B中发生反应的离子方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
②氯水中HClO不稳定,若变质生成盐酸,酸性增强,可选紫色石蕊检验,
A. 硝酸银溶液和氯离子生成白色沉淀,不能检验一瓶氯水是否已经完全变质,故A错误;
B. 酚酞溶液在酸溶液中不变色,故B错误;
C. 碳酸钠溶液和盐酸反应生成二氧化碳气体,不能检验一瓶氯水是否已经完全变质,故C错误;
D.紫色石蕊溶液遇到酸溶液显红色,不褪色说明变质,先变红后褪色证明为变质,能检验一瓶氯水是否已经完全变质,故D正确;
故答案为:D;
③氯水久置变质会生成氯化氢和氧气,故化学方程式是2HClO![]() 2HCl+O2↑
2HCl+O2↑
故答案为:2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(3)氧化性:Br2>Fe3+,氧化性越强对应离子的还原性越弱,所以还原性:Br-<Fe2+,不同还原剂遇到同一种氧化剂时,还原性强的先反应,溴化亚铁溶液中通入氯气,首先被氧化的离子是Fe2+,
故答案为:Fe2+。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案