题目内容
【题目】向200.0mL某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应.在上述所得溶液中,逐滴缓慢滴加2.0molL﹣1的盐酸,所得气体(不考虑溶解)的体积与滴加盐酸的体积关系如图(其中点A是线段OC上的动点):
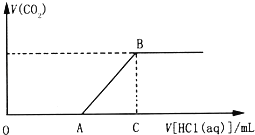
(1)若OA=AC时,通入CO2后,所得溶液的溶质成分是 ________________.
(2)若OA>AC时,OA段发生反应的离子方程式是________________________________
(3)若A点数值为80,C点数值为260,试确定通入CO2后得到的溶液溶质成 分及其物质的量浓度.(有几种填几种,不必填满,成分用化学式表示)
①成分1:________________物质的量浓度:________
②成分2:_______________ 物质的量浓度:_________
③成分3:_______________ 物质的量浓度:_________
④成分4:______________ _物质的量浓度:_________
【答案】Na2CO3 2 OH﹣+H+=H2O CO32﹣+H+=HCO3﹣ 3 (顺序可以颠倒) Na2CO3 0.8mol/L NaHCO3 1.0mol/L
【解析】
NaOH溶液中缓慢通入一定量的CO2,充分反应,所得溶液,可以是碳酸钠,还可以是碳酸氢钠,还可以是碳酸钠和氢氧化钠的混合物,或是碳酸氢钠和碳酸钠的混合物,与盐酸先后发生的反应依次是:NaOH+HCl=NaCl+H2O,Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═NaCl+H2O+CO2↑,以此解答。
(1) AC段有气体二氧化碳生成,AC段的反应是NaHCO3+HCl═NaCl+H2O+CO2↑,根据碳元素守恒,若OA=AC,则OA段只发生Na2CO3+HCl═NaHCO3+NaCl反应,则通入CO2后,所得溶液的溶质成分是Na2CO3;
(2) AC段有气体二氧化碳生成,AC段的反应是NaHCO3+HCl═NaCl+H2O+CO2↑,若OA>AC,则OA段依次发生NaOH+HCl=NaCl+H2O、Na2CO3+HCl═NaHCO3+NaCl反应,溶液的组成是氢氧化钠和碳酸钠的化合物,OA段反应离子方程式依次是OH﹣+H+=H2O (4). CO32﹣+H+=HCO3﹣;
(3)若A点数值为80,C点数值为260,OA<AC,所以溶质是碳酸钠和碳酸氢钠的混合物,在OA段发生反应是Na2CO3+HCl═NaHCO3+NaCl,消耗盐酸的物质的量为:2.0mol/L×0.08L=0.16mol,所以碳酸钠的物质的量是0.16mol,碳酸钠的浓度是:![]() 0.8mol/L,在AC段消耗盐酸的物质的量是2.0mol/L×(0.26-0.08)L=0.36mol,AC段发生的反应是NaHCO3+HCl═NaCl+H2O+CO2↑,OA段反应生成的碳酸氢钠是0.16mol,所以原来的混合液中含有的碳酸氢钠是0.36mol-0.16mol=0.20mol,所以碳酸氢钠的浓度
0.8mol/L,在AC段消耗盐酸的物质的量是2.0mol/L×(0.26-0.08)L=0.36mol,AC段发生的反应是NaHCO3+HCl═NaCl+H2O+CO2↑,OA段反应生成的碳酸氢钠是0.16mol,所以原来的混合液中含有的碳酸氢钠是0.36mol-0.16mol=0.20mol,所以碳酸氢钠的浓度![]() 1.0mol/L。
1.0mol/L。

 阅读快车系列答案
阅读快车系列答案