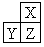
题目内容
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是
A.原子序数: B>A>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
A.原子序数: B>A>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
C
A , B , C ,分别为三种短周期元素,B2+和C-具有相同的电子层结构,说明B为第三周期元素、C为第二周期元素或B为第二周期元素、C为第一周期元素;
当B为第三周期元素、C为第二周期元素时,B2+表示失去2个电子、C-表示得到1个电子,B为镁、C为氟,由于A , B ,在同一周期,A 的最低价阴离子分别为A2-,A2-表示得到2个电子达到8个电子稳定结构,则A为硫元素。
A、原子序数A>B>C,所以A错误;
B原子半径:B>A>C,所以B错误;
C离子半径:A2->C->B2+,正确;
D 原子核外最外层电子数:C>A>B,所以D错误。
同理当B为第二周期元素、C为第一周期元素时,A为氧、B为铍、C为氢。
A、原子序数A>B>C,所以A错误;
B原子半径:B>A>C,所以B错误;
C离子半径:A2->C->B2+,正确;
D 原子核外最外层电子数:A>B>C,所以D错误。
综上所分析可知,只有C正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 水反应,在标准状况下生成11.2LH2
水反应,在标准状况下生成11.2LH2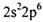 的原子;
的原子;
 的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。 。
。 杂化,分子的立体构型为 。
杂化,分子的立体构型为 。