��Ŀ����
�������仯�����ڹ�ũҵ���������������ж�������Ҫ��Ӧ�á�
(1)Ca(ClO)2��NaClO��NaClO2�Ⱥ��Ȼ����ﶼ�dz��õ���������Ư��,����Ϊ���Ƕ�����������������,��д����ҵ����������NaOH��Һ��Ӧ����������NaClO�����ӷ���ʽ��������������������������������
(2)�ػ�ɫǿ�̼�������Cl2OΪ���ʹ��ϸ�Ч��ȫ���������֮һ,ʵ���ҿ��ó�ʪ��Cl2��Na2CO3��Ӧ��ȡ����Cl2O��NaHCO3�����ӷ���ʽ������������������������������������
(3)��ɫ����ClO2��������ˮɱ��������ˮ������
��KClO3��SO2��ǿ������Һ�з�Ӧ���Ƶ�ClO2,�˷�Ӧ�����ӷ���ʽΪ����������������������������
��ClO2��Ũ���������Cl2,ÿ����1 mol Cl2ת�Ƶ��ӵ����ʵ���Ϊ����������
��ClO2�ɽ���ˮ�е�Mn2+ת��ΪMnO2����ȥ,������ԭΪCl-,�÷�Ӧ�������������뻹ԭ�������ʵ���֮��Ϊ����������
(4)��Cl2����ijЩ�����л���ʱ�����������HCl�����÷�Ӧ4HCl+O2 2Cl2+2H2O,��ʵ���ȵ�ѭ�����á�
2Cl2+2H2O,��ʵ���ȵ�ѭ�����á�
��֪:��������Ӧ��,4 mol HCl�������ų�115.6 kJ��������
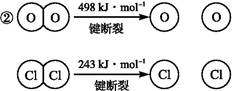
��Ͽ�1 mol H��O����Ͽ�1 mol H��Cl�������������ԼΪ�������� kJ,H2O��H��O����HCl��H��Cl��(�ǿ��������)����������
(1)Ca(ClO)2��NaClO��NaClO2�Ⱥ��Ȼ����ﶼ�dz��õ���������Ư��,����Ϊ���Ƕ�����������������,��д����ҵ����������NaOH��Һ��Ӧ����������NaClO�����ӷ���ʽ��������������������������������
(2)�ػ�ɫǿ�̼�������Cl2OΪ���ʹ��ϸ�Ч��ȫ���������֮һ,ʵ���ҿ��ó�ʪ��Cl2��Na2CO3��Ӧ��ȡ����Cl2O��NaHCO3�����ӷ���ʽ������������������������������������
(3)��ɫ����ClO2��������ˮɱ��������ˮ������
��KClO3��SO2��ǿ������Һ�з�Ӧ���Ƶ�ClO2,�˷�Ӧ�����ӷ���ʽΪ����������������������������
��ClO2��Ũ���������Cl2,ÿ����1 mol Cl2ת�Ƶ��ӵ����ʵ���Ϊ����������
��ClO2�ɽ���ˮ�е�Mn2+ת��ΪMnO2����ȥ,������ԭΪCl-,�÷�Ӧ�������������뻹ԭ�������ʵ���֮��Ϊ����������
(4)��Cl2����ijЩ�����л���ʱ�����������HCl�����÷�Ӧ4HCl+O2
 2Cl2+2H2O,��ʵ���ȵ�ѭ�����á�
2Cl2+2H2O,��ʵ���ȵ�ѭ�����á���֪:��������Ӧ��,4 mol HCl�������ų�115.6 kJ��������

��Ͽ�1 mol H��O����Ͽ�1 mol H��Cl�������������ԼΪ�������� kJ,H2O��H��O����HCl��H��Cl��(�ǿ��������)����������
(1)ǿ������Cl2+2OH- ClO-+Cl-+H2O
ClO-+Cl-+H2O
(2)2Cl2+2C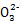 +H2O
+H2O 2HC
2HC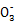 +2Cl-+Cl2O
+2Cl-+Cl2O
(3)��2Cl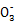 +SO2
+SO2 S
S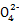 +2ClO2����1.6 mol����2��5
+2ClO2����1.6 mol����2��5
(4)31.9��ǿ
 ClO-+Cl-+H2O
ClO-+Cl-+H2O(2)2Cl2+2C
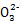 +H2O
+H2O 2HC
2HC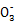 +2Cl-+Cl2O
+2Cl-+Cl2O(3)��2Cl
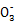 +SO2
+SO2 S
S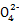 +2ClO2����1.6 mol����2��5
+2ClO2����1.6 mol����2��5(4)31.9��ǿ
(2)������Ϣ��֪Cl2+C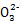
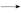 HC
HC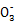 +Cl-+Cl2O,���ݻ��ϼ��غ��֪Cl2+C
+Cl-+Cl2O,���ݻ��ϼ��غ��֪Cl2+C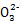
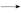 HC
HC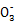 +2Cl-+Cl2O,��ƽ����H������O��֮�������ԭ�ӿɵ�2Cl2+2C
+2Cl-+Cl2O,��ƽ����H������O��֮�������ԭ�ӿɵ�2Cl2+2C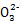
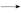 2HC
2HC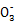 +2Cl-+Cl2O,����H2O���䡰H����2Cl2+2C
+2Cl-+Cl2O,����H2O���䡰H����2Cl2+2C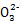 +H2O
+H2O 2HC
2HC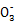 +2Cl-+Cl2O,����á�O�����;(3)�����ݻ�ѧ����ʽ2ClO2+8HCl(Ũ)
+2Cl-+Cl2O,����á�O�����;(3)�����ݻ�ѧ����ʽ2ClO2+8HCl(Ũ) 5Cl2��+4H2O��֪ÿ����5 mol Cl2ת��8 mol����;��������ClO2����Ԫ�صĻ��ϼ۽���5��,��ԭ��Mn�Ļ��ϼ�����2��,�����������뻹ԭ�������ʵ���֮��Ϊ2��5;(4)��Ͽ�1 mol H��O����Ͽ�1 mol H��Cl �����������ֱ�Ϊx��y,�γɻ�ѧ���ų�������(4x+2��243 kJ)���Ͽ���ѧ�����յ�����(4y+498 kJ)����115.6 kJ,�ɵ�x-y="31.9" kJ
5Cl2��+4H2O��֪ÿ����5 mol Cl2ת��8 mol����;��������ClO2����Ԫ�صĻ��ϼ۽���5��,��ԭ��Mn�Ļ��ϼ�����2��,�����������뻹ԭ�������ʵ���֮��Ϊ2��5;(4)��Ͽ�1 mol H��O����Ͽ�1 mol H��Cl �����������ֱ�Ϊx��y,�γɻ�ѧ���ų�������(4x+2��243 kJ)���Ͽ���ѧ�����յ�����(4y+498 kJ)����115.6 kJ,�ɵ�x-y="31.9" kJ
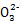
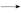 HC
HC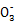 +Cl-+Cl2O,���ݻ��ϼ��غ��֪Cl2+C
+Cl-+Cl2O,���ݻ��ϼ��غ��֪Cl2+C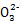
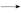 HC
HC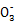 +2Cl-+Cl2O,��ƽ����H������O��֮�������ԭ�ӿɵ�2Cl2+2C
+2Cl-+Cl2O,��ƽ����H������O��֮�������ԭ�ӿɵ�2Cl2+2C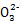
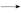 2HC
2HC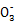 +2Cl-+Cl2O,����H2O���䡰H����2Cl2+2C
+2Cl-+Cl2O,����H2O���䡰H����2Cl2+2C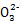 +H2O
+H2O 2HC
2HC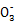 +2Cl-+Cl2O,����á�O�����;(3)�����ݻ�ѧ����ʽ2ClO2+8HCl(Ũ)
+2Cl-+Cl2O,����á�O�����;(3)�����ݻ�ѧ����ʽ2ClO2+8HCl(Ũ) 5Cl2��+4H2O��֪ÿ����5 mol Cl2ת��8 mol����;��������ClO2����Ԫ�صĻ��ϼ۽���5��,��ԭ��Mn�Ļ��ϼ�����2��,�����������뻹ԭ�������ʵ���֮��Ϊ2��5;(4)��Ͽ�1 mol H��O����Ͽ�1 mol H��Cl �����������ֱ�Ϊx��y,�γɻ�ѧ���ų�������(4x+2��243 kJ)���Ͽ���ѧ�����յ�����(4y+498 kJ)����115.6 kJ,�ɵ�x-y="31.9" kJ
5Cl2��+4H2O��֪ÿ����5 mol Cl2ת��8 mol����;��������ClO2����Ԫ�صĻ��ϼ۽���5��,��ԭ��Mn�Ļ��ϼ�����2��,�����������뻹ԭ�������ʵ���֮��Ϊ2��5;(4)��Ͽ�1 mol H��O����Ͽ�1 mol H��Cl �����������ֱ�Ϊx��y,�γɻ�ѧ���ų�������(4x+2��243 kJ)���Ͽ���ѧ�����յ�����(4y+498 kJ)����115.6 kJ,�ɵ�x-y="31.9" kJ
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ