题目内容
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH- Fe3O4+S4O62-+2H2O,有关说法正确的是
Fe3O4+S4O62-+2H2O,有关说法正确的是
| A.每转移1.5mol电子,有1.125mol Fe2+被氧化 |
| B.x = 2 |
| C.Fe2+、S2O32-都是还原剂 |
| D.每生成1mol Fe3O4,转移电子2mol |
C
解析试题分析:在3Fe2++2 S2O32﹣+O2+xOH﹣=Fe3O4+S4O62﹣+2H2O中,化合物中铁元素、硫元素用平均化合价,铁元素的化合价变化:+2→+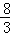 ;硫元素的化合价变化为:+2→+
;硫元素的化合价变化为:+2→+ ;氧元素的化合价变化:0→﹣2,所以氧化剂是O2还原剂是Fe2+、S2O32﹣,还原产物是Fe3O4,设失电子xmol,由3Fe2+﹣﹣Fe3O4﹣失2e﹣,1molFe2+被氧化时失去的电子为
;氧元素的化合价变化:0→﹣2,所以氧化剂是O2还原剂是Fe2+、S2O32﹣,还原产物是Fe3O4,设失电子xmol,由3Fe2+﹣﹣Fe3O4﹣失2e﹣,1molFe2+被氧化时失去的电子为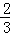 mol,根据氢原子守恒,水的化学计量数为2,则OH﹣的化学计量数为4,即x=4。
mol,根据氢原子守恒,水的化学计量数为2,则OH﹣的化学计量数为4,即x=4。
考点:本题主要考查Fe3O4是复杂的化合物,铁元素既有+2价也有+3价,把Fe3O4中铁元素的化合价用平均化合价处理,S2O32﹣的硫元素的化合价用平均化合价处理是解本题的关键,本题难度较大,需细心分析。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案下列类型的反应,一定发生电子转移的是( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
在化学反应中,某元素由化合态变为单质,则该元素
| A.一定被氧化 | B.一定被还原 |
| C.既可能被氧化,也可能被还原 | D.以上都不是 |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是 ( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在潮湿的空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
| A.+4 | B.+3 | C.+2 | D.+1 |
将反应 4(NH4)2SO4→ N2↑+6NH3↑+3SO2↑+SO3↑+7H2O 的产物气体通入BaCl2溶液,下列判断正确的是
| A.无沉淀生成 | B.肯定没有BaSO3生成 |
| C.得到的沉淀是纯净物 | D.得到的沉淀是BaSO4和BaSO3组成的混合物 |
向酸化过的MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82—+H2O―→MnO4—+SO42—+H+。下列说法不正确的是 ( )。
| A.可以利用该反应检验Mn2+ |
| B.氧化性比较:S2O82—>MnO4— |
| C.MnSO4溶液可以使用盐酸酸化 |
| D.若有0.1 mol氧化产物生成,则转移电子0.5 mol |
 mol
mol mol
mol L
L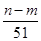 +
+ 的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使
的酸性溶液,使溶液中的Fe2+恰好全部氧化,并使