题目内容
现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
| A.+4 | B.+3 | C.+2 | D.+1 |
A
解析试题分析:根据氧化还原反应中得失电子守恒计算。根据题意知,该反应中SO32-为还原剂,SO32-被氧化,为SO42-,化合价从+4升到+6价失电子数=0.1mol/L×0.03L×2=0.006mol,XO4-为氧化剂,X元素化合价降低,设元素X在还原产物中的化合价为n,根据得失电子守恒得2×10-3 mol(7—n)=0.006mol,解得n=4,选A。
考点:考查氧化还原反应相关的计算。

练习册系列答案
相关题目
水热法制备Fe3O4纳米颗粒的总反应:3Fe2++2S2O32-+O2+xOH- Fe3O4+S4O62-+2H2O,有关说法正确的是
Fe3O4+S4O62-+2H2O,有关说法正确的是
| A.每转移1.5mol电子,有1.125mol Fe2+被氧化 |
| B.x = 2 |
| C.Fe2+、S2O32-都是还原剂 |
| D.每生成1mol Fe3O4,转移电子2mol |
FeS2可在Fe2(SO4)3溶液中“溶解”,硫元素都以SO42-的形式存在。若有l mol FeS2“溶解”,则生成H2SO4的物质的量为
| A.2mol | B.4 mol | C.6 mol | D.8 mol |
已知下列离子在酸性条件下都能氧化KI,它们自身发生如下变化:① Cr2O72-→ Cr3+,②IO3-→ I2,③MnO4-→ Mn2+。如果分别用等物质的量的这些离子氧化足量的KI,得到I2的物质的量由多到少的顺序正确的是
| A.②=③>① | B.①>②=③ | C.②>③>① | D.①=②>③ |
分类是常用的学习方法,对于反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑的分类错误的是
| A.化合反应 | B.氧化还原反应 | C.离子反应 | D.放热反应 |
化学上,通常把有化合价变化的反应称作氧化还原反应,下列反应属于氧化还原反应的是( )
| A.CO2+H2O=H2CO3 |
B.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
C.CaCO3 CO2↑+ CaO CO2↑+ CaO |
| D.CuSO4+2NaOH =Cu(OH)2↓+Na2SO4 |
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于区域3的是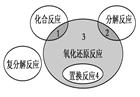
| A.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
B.2KMnO4 K2MnO4+MnO2+O2↑ K2MnO4+MnO2+O2↑ |
C.4NH3+5O2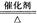 4NO+6H2O 4NO+6H2O |
| D.Fe+CuSO4=FeSO4+Cu |
有一未完成的离子方程式:□□+ XO3-+6H+═3X2+3H2O,据此判断X元素的最高化合价为
| A.+7 | B.+6 | C.+5 | D.+1 |
日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
| A.铜铸塑像上出现铜绿[Cu2(OH)2CO3] |
| B.用石膏粉制作石膏雕像 |
| C.用铝质或铁质容器盛放浓硝酸 |
| D.酸雨的形成 |