题目内容
【题目】环境监测显示,某地市的主要气体污染物为SO2、NOx、CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:![]() ΔH=-241.8kJ·mol-1
ΔH=-241.8kJ·mol-1
![]() ΔH=-110.5kJmol-1
ΔH=-110.5kJmol-1
写出焦炭与1mol水蒸气反应生成水煤气的热化学方程式:________。
(2)①在101 kPa时,H2(g)在 1.00 mol O2(g)中完全燃烧生成2.00 mol H2O(l)放出571.6 kJ的热量,表示H2燃烧热的热化学方程式为________________________________。
②1.00 L 1.00 mol·L1 H2SO4溶液与2.00 L 1.00 mol·L1 NaOH溶液完全反应,放出114.6 kJ热量,表示其中和热的热化学方程式为____________________________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。
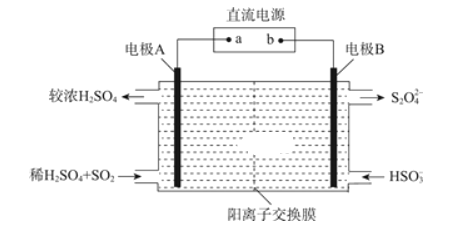
电极A的电极反应式为________;
【答案】C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol-1 ![]()
![]()
![]()
【解析】
(1)根据盖斯定律进行计算,用第一个热化学方程式减去第二个热化学方程式可得焦炭与水蒸气反应的热化学方程式;
(2)①燃烧热指的是1mol物质完全燃烧生成稳定的物质时放出的热量,据此写出热化学方程式;
②中和热为稀酸和稀碱反应生成1mol H2O(l)放出的热量,据此写出热化学方程式;
(3)由图可知,电极A为阳极,SO2失电子发生氧化反应生成![]() ,据此写出电极反应方程式。
,据此写出电极反应方程式。
(1)已知:①![]() ΔH=-241.8kJ·mol-1
ΔH=-241.8kJ·mol-1
②![]() ΔH=-110.5kJmol-1,
ΔH=-110.5kJmol-1,
水煤气的主要成分为CO、H2O,根据盖斯定律,②-①可得焦炭与1mol水蒸气反应生成水煤气的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol-1;
故答案为:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol-1;
(2)①由题可知,![]() , H2的燃烧热热化学方程式即1molH2完全燃烧生成1mol液态水的热化学方程式,根据盖斯定律将该热化学反应方程式×
, H2的燃烧热热化学方程式即1molH2完全燃烧生成1mol液态水的热化学方程式,根据盖斯定律将该热化学反应方程式×![]() 可得H2的燃烧热的热化学方程式:
可得H2的燃烧热的热化学方程式:![]() ;
;
故答案为:![]() ;
;
②由题可知,![]() ,该反应的中和热为表示生成1mol水的热化学方程式,将上述热化学方程式×
,该反应的中和热为表示生成1mol水的热化学方程式,将上述热化学方程式×![]() 可得该反应的中和热为:
可得该反应的中和热为:![]() ;
;
故答案为:![]() ;
;
(3)由图可知,电极A为阳极,SO2失电子发生氧化反应生成![]() ,故电极反应方程式为:
,故电极反应方程式为:![]() ;
;
故答案为:![]() 。
。

 综合自测系列答案
综合自测系列答案