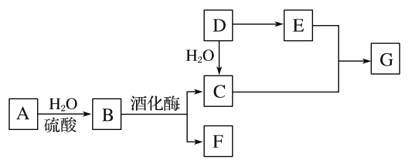
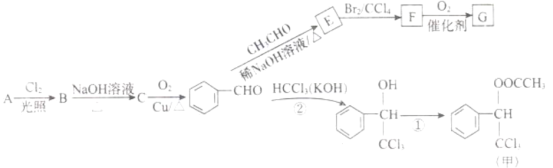
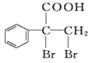
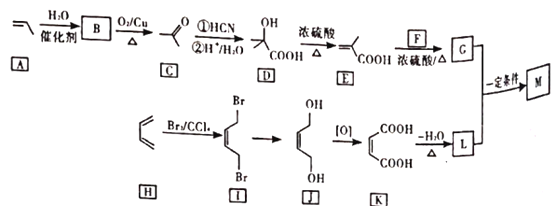
题目内容
【题目】(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_________________、_______
(2)实验时大烧杯上若不加盖板,求得中和热![]() 的数值__________
的数值__________![]() 填“偏大”“偏小”或“无影响”
填“偏大”“偏小”或“无影响”![]() 。
。
(3)由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如右表所示。
![]() 设充分反应后溶液的比热容
设充分反应后溶液的比热容![]() ,忽略实验仪器的比热容及溶液体积的变化,则
,忽略实验仪器的比热容及溶液体积的变化,则![]() ____________________;
____________________;![]() ____________________。
____________________。![]() 已知溶液密度均为
已知溶液密度均为![]()
![]() 原因是_____________________________________________________________。
原因是_____________________________________________________________。
反应物 | 起始温度 | 终了温度 | 中和热 |
A. |
|
|
|
B. |
|
|
|
【答案】环形玻璃搅拌棒 量筒 偏大 ![]()
![]()
![]() 是强碱,
是强碱,![]() 是弱碱,电离吸热
是弱碱,电离吸热
【解析】
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒;
(2)加盖板会导致热量散失,结合计算公式分析;
(3)![]() 根据
根据![]() 计算;
计算;
②NH3H2O为弱电解质,电离吸热。
![]() 中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒;故答案为:环形玻璃搅拌棒;量筒;
中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、环形玻璃搅拌棒、量筒;故答案为:环形玻璃搅拌棒;量筒;
![]() 实验时大烧杯上若不加盖板,热量散失,根据
实验时大烧杯上若不加盖板,热量散失,根据![]() ,温度变化值减小,求得中和热
,温度变化值减小,求得中和热![]() 的数值偏大;故答案为:偏大;
的数值偏大;故答案为:偏大;
![]() 由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如右表所示。
由甲、乙两人组成的实验小组,在同样的实验条件下,用同样的实验仪器和方法进行两组测定中和热的实验,实验试剂及其用量如右表所示。![]() 设充分反应后溶液的比热容
设充分反应后溶液的比热容![]() ,忽略实验仪器的比热容及溶液体积的变化,则
,忽略实验仪器的比热容及溶液体积的变化,则![]() ;
;![]() ,故答案为:
,故答案为:![]() ;
; ![]() ;
;
![]() 找
找![]() 的原因先去找差别,可知NaOH是强碱,
的原因先去找差别,可知NaOH是强碱,![]() 是弱碱,电离吸热;故答案为:NaOH是强碱,
是弱碱,电离吸热;故答案为:NaOH是强碱,![]() 是弱碱,电离吸热。
是弱碱,电离吸热。

【题目】工业生产硫酸接触室发生如下化学反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
2SO3(g) ΔH=-196.6kJ·mol-1。一定温度下,向甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如表所示,下列判断中,正确的是( )
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2)/mol | 0.6 | 1.2 | 1.2 |
n(O2)/mol | 0.36 | 0.36 | 0.72 | |
SO2的平衡转化率 | 80% | α1 | α2 | |
A.甲→乙,平衡向正反应方向移动,α(O2)增大,放出的热量为47.18kJ
B.平衡时,丙中c(SO2)是甲中的2倍
C.平衡时,SO2的转化率:α2>80%>α1
D.该温度下,平衡常数K=400