题目内容
【题目】下列说法正确的是( )
①金属氧化物一定是碱性氧化物 ②碱性氧化物一定是金属氧化物
③酸性氧化物一定是非金属氧化物 ④非金属氧化物不一定是酸性氧化物
⑤能电离出![]() 的化合物一定是酸 ⑥
的化合物一定是酸 ⑥![]() 属于一元酸
属于一元酸
⑦含有氧元素的化合物都是氧化物 ⑧酸性氧化物不一定能与水化合生成酸
A.2个B.3个C.4个D.5个
【答案】C
【解析】
金属氧化物不一定是碱性氧化物,如Na2O2,Al2O3等,①错误;碱性氧化物一定是金属氧化物,②正确;酸性氧化物不一定是非金属氧化物,如Mn2O7,③错误;有些非金属氧化物就不属于酸性氧化物,如CO,NO等,④正确;解离出的阳离子只有H+的化合物才称之为酸,NaHSO4溶于水就可以解离出H+,但它属于盐类,⑤错误;一分子醋酸只能解离出一个H+,所以属于一元酸,⑥正确;氧化物是指含有两种元素,其中一种是O的化合物,醋酸虽然也含氧,但就不属于氧化物,⑦错误;二氧化硅属于酸性氧化物,但是不能与水反应,无法生成硅酸,⑧正确;综上所述②④⑥⑧正确;
答案选C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】氮的氧化物(如NO2、N2O4、N2O5等)应用很广,在一定条件下可以相互转化。
(1)已知:N2O5在一定条件下发生分解2N2O5(g) ![]() 4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
T/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N2O5)/mol·L-1 | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
设反应开始时体系压强为p0,第2.00 min时体系压强为p,则p∶p0=________;1.00~3.00 min内,O2的平均反应速率为________。
(2)在N2O4与NO2之间存在反应:N2O4(g)![]() 2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
2NO2(g)。将1 mol的N2O4放入1 L的恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
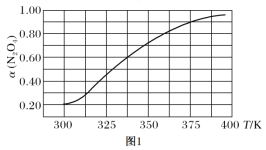
①337.5 K时,反应的平衡常数K=________(填写计算结果)。
②据图推测N2O4(g) ![]() 2NO2(g)是吸热反应,理由是_______________。
2NO2(g)是吸热反应,理由是_______________。
③对于反应N2O4(g)![]() 2NO2(g),用平衡时各组分压强关系表达的平衡常数
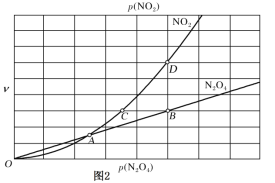
2NO2(g),用平衡时各组分压强关系表达的平衡常数![]() 。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。
。在一定条件下N2O4与NO2的消耗速率与自身压强间存在关系:v(N2O4)=k1·p(N2O4),v(NO2)=k2· [p(NO2)]2。其中,k1、k2是与反应及温度有关的常数。相应的速率—压强关系如图所示:一定温度下,k1、k2与平衡常数Kp的关系是k1=________,在图标出的点中,指出能表示反应达到平衡状态的点并说明理由___。