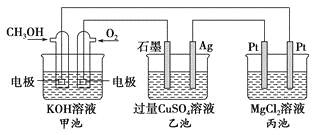
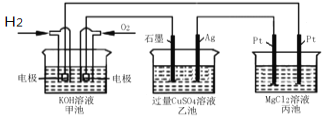
题目内容
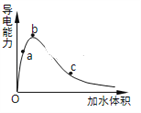
【题目】在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
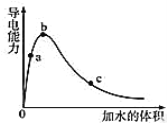
(1)a、b、c三点醋酸电离程度由大到小的顺序为________;a、b、c三点对应的溶液中c(H+)最大的是________。
(2)若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=________________。
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(_______)。
A.c(H+) B.溶液pH C.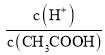 D.CH3COOH分子数
D.CH3COOH分子数
【答案】c>b>a b 10-6 C
【解析】
(1)醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大;导电能力越强,离子浓度越大,氢离子浓度越大,pH越小;
(2)根据电离平衡常数Ka的含义书写、计算;
(3)加水稀释,促进电离,n(CH3COO-)、n(H+)增大,但浓度减小,以此解答。
(1)醋酸是弱电解质,所以醋酸溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液体积越大,醋酸的电离程度越大,根据图象知,水的体积越大,溶液的浓度越小,醋酸的电离程度越大,所以醋酸电离程度由大到小的顺序是c>b>a;
溶液的导电能力与离子浓度成正比,所以溶液导电能力越大氢离子浓度越大,则根据物质的导电性大小顺序可知在a、b、c三点对应的溶液中,氢离子浓度最大的为b;
(2)经实验测得c点处:c(CH3COOH)=0.01mol/L,c(CH3COO-)=0.0001mol/L,由于在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,则c(H+)=c(CH3COO-)=0.0001mol/L,所以该条件下CH3COOH的电离常数Ka=
CH3COO-+H+,则c(H+)=c(CH3COO-)=0.0001mol/L,所以该条件下CH3COOH的电离常数Ka=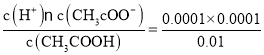 =10-6;
=10-6;
(5)A.在稀释过程中,溶液的体积增大,氢离子的浓度减小,A错误;
B.弱电解质越稀,电离度越大,在稀释过程中,溶液的体积增大,氢离子的浓度减小,所以溶液的pH增大,当溶液无限稀释时,溶液的pH无限接近于7但小于7,B错误;
C.加水稀释,促进电离,n(CH3COO-)、n(H+)增大,n(CH3COOH)减小,则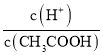 增大,C正确;
增大,C正确;
D.弱电解质越稀,电离度越大,平衡向右移动,CH3COOH分子数减少,D错误;
故合理选项是C。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。