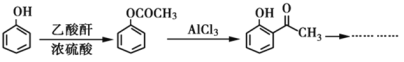
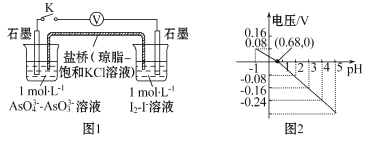
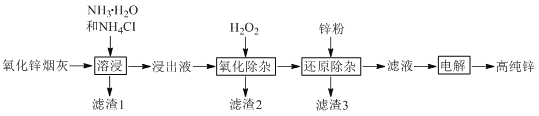
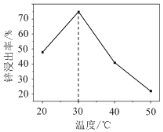
题目内容
【题目】(1)K2SO4和Al2(SO4)3饱和溶液中c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1。
①写出Al2(SO4)3的电离方程式____________。
②c(Al3+)等于______mol·L-1。
(2)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。回答下列问题。
①除去Mg2+,需要加入的碱溶液为(从下列选项中选出答案,填字母,下同):___;除去SO42-,需要加入的盐溶液为:______。
A.NaOH B.KOH C.BaCl2 D.Ba(NO3)2
②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是:除去_____和_____。(填写离子符号)
③将经过操作②后的悬浊液过滤,滤液中还有两种杂质,最后在滤液中加入适量的溶液是(填溶质化学式)_________。
【答案】Al2(SO4)3=2Al3++3SO42- 0.4 A C Ca2+ Ba2+ HCl
【解析】
(1)①Al2(SO4)3是强电解质,在溶液中发生完全电离;②根据K2SO4和Al2(SO4)3混合溶液中溶液中正负离子之和为0可知,![]() ,由于c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1,可以解得;
,由于c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1,可以解得;
(2)①除去Mg2+,需要加入碱溶液,为了不引入新的杂质,因此需要加入NaOH溶液;除去SO42-,需要加入钡盐,为了不引入新的杂质,加入BaCl2;②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止,是为了除去粗盐中的Ca2+,以及操作①未反应的Ba2+;③将经过操作②后的悬浊液过滤,滤液中还有CO32-和OH-两种杂质,为除去这两种杂质,最后在滤液中加入HCl。
(1)①Al2(SO4)3是强电解质,在溶液中发生完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-;②根据K2SO4和Al2(SO4)3混合溶液中溶液中正负离子之和为0可知,![]() ,由于c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1,故
,由于c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1,故![]() =0.4mol/L;
=0.4mol/L;
(2)①除去Mg2+,需要加入碱溶液,为了不引入新的杂质,因此需要加入NaOH溶液,答案选A;除去SO42-,需要加入钡盐,为了不引入新的杂质,加入BaCl2,答案选C;②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止,是为了除去粗盐中的Ca2+,以及操作①未反应的Ba2+;③将经过操作②后的悬浊液过滤,滤液中还有CO32-和OH-两种杂质,为除去这两种杂质,最后在滤液中加入HCl,反应的离子方程式为:H++OH-=H2O,CO32-+2H+=CO2+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列关于同分异构体(不考虑立体异构)的数目判断正确的是( )
选项 | A | B | C | D |
分子式(或结构简式) | C5H10O2 | C5H10 |
| C7H16 |
已知条件 | 能与碳酸氢钠反应 | 能使溴 水褪色 | 一氯代物 | 分子中含 有3个甲基 |
同分异构体数目 | 4 | 3 | 4 | 5 |
A. AB. BC. CD. D