题目内容
【题目】已知:
![]()
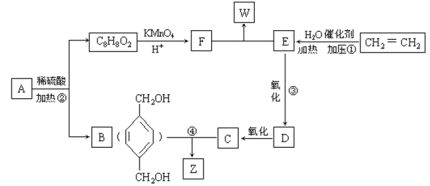
从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,F的核磁共振氢谱只有两种峰,W和Z互为同分异构体。
回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个取代基的化合物有___种(不包括对映异构体)。
(4)A的结构简式可能为_________________________________。
(5)已知酯与醇有如下反应:
RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)
RCOOR″+R′OH(R、R′、R″代表烃基)
B与W在上述条件下可形成高分子化合物Q,请写出B与W生成Q的化学方程式________。
(6)同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮:
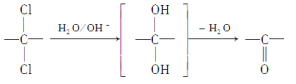
根据已有知识并结合相关信息,写出以对二甲苯为原料(其他无机试剂任选)制备![]() 的合成路线。__________________
的合成路线。__________________
合成路线示意图,如:
【答案】加成应 取代反应(或水解反应) 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O 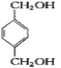 +2CH3COOH
+2CH3COOH![]()
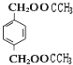 +2H2O; 12
+2H2O; 12 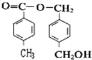 n
n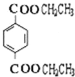 +n
+n![]()
![]()
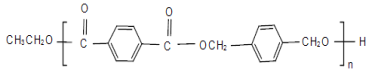 +(2n-1)CH3CH2OH
+(2n-1)CH3CH2OH ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
乙烯与水发生加成反应生成E为CH3CH2OH,E发生氧化反应生成D为CH3CHO,D进一步氧化生成C为CH3COOH.B和C按1:2发生酯化反应生成Z为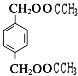 ,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含-COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为
,A水解得到C8H8O2与B,可推知A含有酯基,C8H8O2中含-COOH,且能被酸性高锰酸钾溶液溶液氧化得到F,F和E按1:2反应生成W,则F为二元羧酸,故C8H8O2为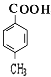 ,F为
,F为 ,W为
,W为 ,A为
,A为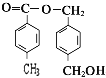 ,以此解答该题。
,以此解答该题。
(1)反应①是乙烯与水发生加成反应生成乙醇,反应②为取代反应,也为水解反应,故答案为:加成反应;取代反应(或水解反应);
(2)反应③的化学反应方程式为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,
2CH3CHO+2H2O,
反应④的化学反应方程式为: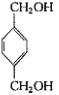 +2CH3COOH
+2CH3COOH![]()
 +2H2O;
+2H2O;
故答案为:2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O,
2CH3CHO+2H2O, +2CH3COOH
+2CH3COOH![]()
 +2H2O;
+2H2O;
(3)B为![]() ,与B互为同分异构体,属于酚类则含有酚羟基,且苯环上只有两个取代基的化合物,另一个取代基可以是-CH2CH2OH、-CH2-O-CH3、- O-CH2CH3、
,与B互为同分异构体,属于酚类则含有酚羟基,且苯环上只有两个取代基的化合物,另一个取代基可以是-CH2CH2OH、-CH2-O-CH3、- O-CH2CH3、![]() ,每个取代基与酚羟基在相邻、相间、相对位置共有三种同分异构体,这四个取代基共有12种同分异构体,故答案为12;
,每个取代基与酚羟基在相邻、相间、相对位置共有三种同分异构体,这四个取代基共有12种同分异构体,故答案为12;
(4)由以上分析可知F为![]() ,则A为:
,则A为: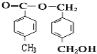 ,故答案为:
,故答案为: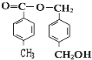
(5)结合信息RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烃基)可得B与W生成Q的化学方程式:n
RCOOR″+R′OH(R、R′、R″代表烃基)可得B与W生成Q的化学方程式:n +n
+n![]()
![]()
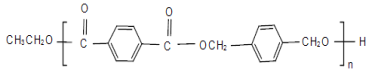 +(2n-1)CH3CH2OH
+(2n-1)CH3CH2OH
故答案为:n +n
+n![]()
![]()
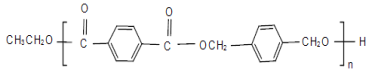 +(2n-1)CH3CH2OH
+(2n-1)CH3CH2OH
(6)![]() 的合成路线为:
的合成路线为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
故答案为:![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

【题目】在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
成分 | 质量(g) | 摩尔质量(g·mol-1) |
蔗糖 | 25.00 | 342 |
硫酸钾 | 0.87 | 174 |
阿司匹林 | 0.17 | 180 |
高锰酸钾 | 0.316 | 158 |
硝酸银 | 0.075 | 170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是__________________。
A.蔗糖B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)配制上述1L上述“鲜花保鲜剂”所需的仪器有:量筒、玻璃棒、药匙、烧杯、托盘天平、__________________、__________________(在横线上填写所缺仪器的名称),需要高锰酸钾___________mol。
(3)在溶液配制过程中,下列操作对配制结果没有影响的是___________________。
A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(4)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为________mol·L-1。