��Ŀ����
����Ŀ��KClO3��Ũ������һ���¶��·�Ӧ�ɱ�ʾΪKClO3+HCl��Ũ���TKCl+ClO2��+Cl2��+H2O
��1������ƽ������ѧ����ʽ��
��2���������ת�Ʒ������Ŀ
��3���������� �� ��ԭ������ �� ��д��ѧʽ��
��4��Ũ�����ڷ�Ӧ����ʾ�����������������ţ���
��ֻ�л�ԭ�� �ڻ�ԭ�Ժ����� ��ֻ�������� �������Ժ�����
��5������0.1mol Cl2 �� ת�Ƶ��ӵ����ʵ���Ϊmol��
���𰸡�
��1��2|4|2|2|1|2
��2��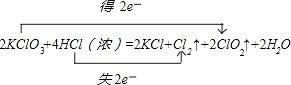
��3��KClO3,Cl2
��4����
��5��0.2
���������⣺��1��KClO3����Ԫ�ػ��ϼ���+5�۽���ΪClO2��+4�ۣ����ϼ۽���1�ۣ�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����ϼ�����2�ۣ����ϼ�������С������Ϊ2����ClO2ϵ��Ϊ2��Cl2ϵ��Ϊ1������KClO3ϵ��Ϊ2��KClϵ��Ϊ2��HClϵ��Ϊ4��ˮ��ϵ����2����ӦΪ2KClO3+4HCl��Ũ���T2KCl+2ClO2��+Cl2��+2H2O��
��2���÷�Ӧ��ת�Ƶ���Ϊ2e���������ת�Ƶķ������ĿΪ�� 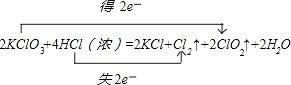 ��
��
��3��ClԪ�صĻ��ϼ۽��ͣ���KClO3Ϊ���������õ����ӱ���ԭ����ԭ����ΪCl2��
��4����Ӧ2KClO3+4HCl��Ũ��=2KCl+Cl2��+2ClO2��+2H2O�У�HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۿ�֪��HCl����Ԫ�ر�������������KCl������HCl�Ļ�ԭ�ԡ����ԣ�
��5����Ӧ��ֻ��Cl2���������HCl����Ԫ�ػ��ϼ��ɩ�1������ΪCl2��0�ۣ����Բ���0.1molCl2��ת�Ƶĵ��ӵ����ʵ���Ϊ0.1mol��2=0.2mol��
���Դ��ǣ���1��2��4��2��2��1��2����2��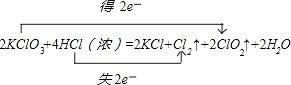 ����3��KClO3��Cl2����4���ڣ���5��0.2��
����3��KClO3��Cl2����4���ڣ���5��0.2��

 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�����Ŀ������������Ϣ�ͱ�־���ж�����˵��������ǣ�������
A | B | C | D |
����ũ���ݾ������أ�����ܡ�ֹ���������� | ̼������ҩƬ |
|
|
�Ŵ��й�������������ƿ��� | ��ҩ�ǿ���ҩ������ʱ��Щ�������ҩЧ | �����иñ�־�Ķ����ӦԶ�벢���� | ���иñ�־����Ʒ�ǿɻ����� |
A.A
B.B
C.C
D.D