题目内容
甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g) CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
①已知:CH3OH (g)+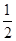 O2 (g)
O2 (g) CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol
CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol
H2(g)+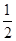 O2 (g)
O2 (g) H2 O(g) ?H2= —120.9kJ/mol
H2 O(g) ?H2= —120.9kJ/mol
则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
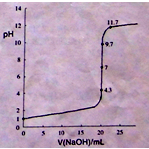
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
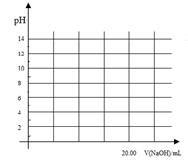
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)
 CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。 | 时间 物质 | 0 min | 10 min | 30 min | 60 min | 70 min |
| CO2(mol/L) | 0 | 0.2 | 0.6 | 0.8 | 0.8 |
| CH3OH(mol/L) | 1.0 | 0.8 | 0.4 | 0.2 | 0.2 |
①已知:CH3OH (g)+
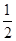 O2 (g)
O2 (g) CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol
CO2(g) + 2H2 (g) ?H1= —192.9kJ/mol H2(g)+
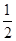 O2 (g)
O2 (g) H2 O(g) ?H2= —120.9kJ/mol
H2 O(g) ?H2= —120.9kJ/mol 则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL)

(1)①-72.0kJ/mol (3分)
② 0.06 (3分)
③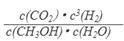
④CD (3分,全对才给分)
(2)①< (2分)
②(起点1(1分);20.00mL对应7(1分);两个突跃点(1分))(3分)
② 0.06 (3分)
③
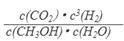
④CD (3分,全对才给分)
(2)①< (2分)
②(起点1(1分);20.00mL对应7(1分);两个突跃点(1分))(3分)

试题分析: (1)①根据盖斯定律和已知方程式,可得甲醇和水蒸气催化重整的方程式=①-②,所以焓变△H3=?H1—?H2=" —192.9kJ/mol" +120.9kJ/mol=-72.0kJ/mol。
②根据已知方程式可得反应速率v(H2) =3v(CO2)=3×(0.6 mol/L-0.2 mol/L)÷20min="0.06" mol/(L·min)。
③参与该反应的都是气体,所以该反应的平衡常数表达式为
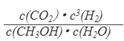 。
。④要使n(CH3OH)/n(CO2)减小,则采取的措施必须能使反应的平衡正向移动,所以A项加入催化剂不能改变平衡,A错误;B项恒容充入氦气,体系整体压强增大,但是实际参与反应的气体浓度没有发生改变,所以平衡不移动,B错误;C项将氢气从体系和中分离,氢气浓度减小,平衡正向移动,C可行;D项再充入H2O,同样使平衡正向移动,D可行;故选CD。
(2)①甲酸是一元弱酸,如果甲酸和等浓度的氢氧化钠等体积混合,则酸碱恰好完全中和生成甲酸钠盐溶液,但是甲酸钠水解呈碱性,所以要是混合后的溶液呈中性,则加入的碱应该小于20. 00 mL。
②若将甲酸换成盐酸,则恰好中和时溶液呈中性,且消耗的碱与酸体积相等都是20.00ml,所以用氢氧化钠滴定盐酸,其滴定曲线满足一般规律,起点pH=1,在终点处消耗氢氧化钠体积约为20.00ml,且溶液pH在4.3-9.7之间存在突变,根据描述画出滴定曲线图应该为:


练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
 Cl2(g)=NaCl(s) ΔH1
Cl2(g)=NaCl(s) ΔH1 △H 2+
△H 2+

 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2 O2(g)=H2O(1) △H2=-285.8 kJ/mol
O2(g)=H2O(1) △H2=-285.8 kJ/mol 2NH3 △H ="-92.4" kJ/mol,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题:
2NH3 △H ="-92.4" kJ/mol,开始他们将N2和H2混合气体20mol (体积比1:1)充入5L合成塔中.反应前压强为P0,反应过程中压强用P表示,反应过程中P/P0与时间t的关系如图所示。请回答下列问题: