题目内容
【题目】下列离子方程式与所述事实相符且书写正确的是
A. 用铁作电极电解饱和氯化钠溶液:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B. 碱性镉镍可充电电池的正极反应:NiO(OH)-e-+H2O==Ni(OH)2+OH-
C. AgOH沉淀溶于氨水:AgOH+2NH3·H2O==[Ag(NH3)2]++OH-+2H2O
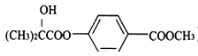
D. 已知苯甲酸的酸性比碳酸强,向 溶液中通入过量CO2:
溶液中通入过量CO2: +2CO2+2H2O—→
+2CO2+2H2O—→![]() +2HCO
+2HCO![]()
【答案】C
【解析】A、阳极铁溶解生成Fe2+,与阴极附近H+放电后生成的OH-结合生成Fe(OH)2沉淀;B、电池的正极是得电子的一极;C、Ag+与NH3分子形成配合离子[Ag(NH3)2]+,使AgOH沉淀溶解;D、只能是较强的酸与较弱酸的盐发生反应。
A、电解时,铁作阳极,失去电子而溶解,生成Fe2+,阴极上由于H+放电生成氢气,破坏了水的电离平衡,使溶液中OH-浓度增大,进而与Fe2+反应生成Fe(OH)2沉淀,所以A不正确;
B、电池的负极失去电子,电子经导线流向电池的正极,所以正极是得电子的一极,故B不正确;
C、Ag+具有空轨道,而NH3分子具有孤对电子,二者可以形成配合离子[Ag(NH3)2]+,使AgOH沉淀溶解,所以C正确;
D、苯甲酸的酸性比碳酸的强,碳酸的酸性比苯酚的强,向![]() 溶液中通入过量CO2,只能与酚钠—ONa反应,而不能与羧酸钠—COONa反应,所以D不正确。本题答案为C。
溶液中通入过量CO2,只能与酚钠—ONa反应,而不能与羧酸钠—COONa反应,所以D不正确。本题答案为C。

【题目】下表为元素周期表的一部分,回答下列有关问题(填写化学符号):
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ⑴ | ⑻ | ⑵ | |||||
三 | ⑶ | ⑷ | ⑸ | ⑹ | ⑺ | ⑼ | ||
四 | ⑽ | ⑾ | ⑿ |
(1)⑴-⑿元素的最高价氧化物对应的水化物中,酸性最强的是______,碱性最强的是_____。
(2)元素⑼在周期表中的位置_______________,若⑻的一种核素中含有10个中子,用![]() 表示该原子:______________。
表示该原子:______________。
(3)在⑴-⑿元素中,原子半径最小的是______________,原子半径最大的是__________。
(4)第三周期简单阴离子半径最大的离子是____________
【题目】已知: ①1mol晶体硅中含有2molSi-Si键。②Si(s)+O2(g)=SiO2(s)ΔH,其反应过程与能量变化如图所示。
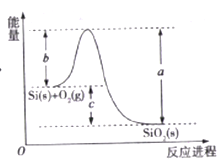
③
化学键 | Si-O | O=O | Si-Si |
断开1mol共价键所需能量/KJ | 460 | 500 | 176 |
下列说法正确的是
A. 晶体硅光伏发电是将化学能转化为电能的
B. 二氧化硅稳定性小于硅的稳定性
C. ΔH=-988 kJ/mol
D. ΔH=a-c
【题目】![]() 盐酸与
盐酸与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是____________________。能否改用铜丝_______(填“能、否”),原因是____________________________
(2)大烧杯上如不盖硬纸板,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(3)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替![]() 溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(5)取![]() 溶液和
溶液和![]() 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
|
| 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________________ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
则中和热![]() __________(取小数点后一位。)(本题中
__________(取小数点后一位。)(本题中![]() 溶液和硫酸溶液的密度均取
溶液和硫酸溶液的密度均取![]() ,中和后生成溶液的比热容取
,中和后生成溶液的比热容取![]() )
)