题目内容
【题目】乙烯、苯乙烯均是重要的化工原料。
![]() 工业上可用乙苯催化脱氢方法制备苯乙烯
工业上可用乙苯催化脱氢方法制备苯乙烯
①已知部分化学键的键能如下:
化学键 | C-H | C-C |
| H-H |
键能/(kJ/mol) | 412 | 348 | 612 | 436 |
则![]() +H2(g)的
+H2(g)的![]() ________kJ/mol。
________kJ/mol。
②实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂![]() 水蒸气不参加反应
水蒸气不参加反应![]() 。在一定压强、900 K的条件下,乙苯的平衡转化率随着
。在一定压强、900 K的条件下,乙苯的平衡转化率随着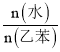 的增大而________
的增大而________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() 。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________
。随着反应的进行,少量积碳会使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是____________![]() 用化学方程式表示
用化学方程式表示![]() 。
。
![]() 苯乙烯可由乙苯和
苯乙烯可由乙苯和![]() 催化脱氢制得。其反应历程如下:
催化脱氢制得。其反应历程如下:
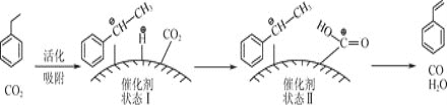
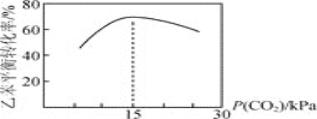
乙苯平衡转化率与![]() 的关系如图所示,当P(CO2)< 15 kPa时,乙苯平衡转化率随着
的关系如图所示,当P(CO2)< 15 kPa时,乙苯平衡转化率随着![]() 增大而增大,其原因是__________,当P(CO2)> 15 kPa时,乙苯平衡转化率随着
增大而增大,其原因是__________,当P(CO2)> 15 kPa时,乙苯平衡转化率随着![]() 增大反而减小,其原因是____________。
增大反而减小,其原因是____________。
![]() 研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下22.4L的
研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛,以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为 ________。若该电池消耗标准状况下22.4L的![]() ,则外电路中理论上转移电子的物质的量为________。
,则外电路中理论上转移电子的物质的量为________。
(4)上海交通大学仇毅翔等研究了不同含金化合物催化乙烯加氢![]() 的反应历程如下图所示:
的反应历程如下图所示:

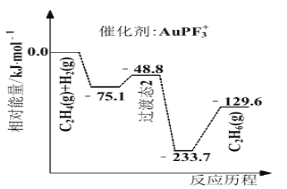
则![]() ____________,催化乙烯加氢效果较好的催化剂是________(选填“
____________,催化乙烯加氢效果较好的催化剂是________(选填“![]() ”或“
”或“![]() ”)。
”)。
【答案】+124 增大 C+H2O(g)![]() CO+H2 随着
CO+H2 随着![]() 压强增大,反应物浓度增大,促进平衡向右移动 过多的
压强增大,反应物浓度增大,促进平衡向右移动 过多的![]() 会造成催化剂表面乙苯的吸附下降
会造成催化剂表面乙苯的吸附下降 ![]() -8e-+3H2O=
-8e-+3H2O=![]() +8 H++CO2 4mol 129.6 AuPF3+
+8 H++CO2 4mol 129.6 AuPF3+
【解析】
(1)①反应热=反应物总键能生成物总能键能,由有机物的结构可知,应是CH2CH3中总键能与CH=CH2、H2总键能之差;
②恒压下,加入水蒸气稀释剂,相当于增大容器体积;高温下,水蒸气可与碳反应;
(2)由反应历程可知乙苯与二氧化碳在催化条件下反应生成苯乙烯和一氧化碳,增大二氧化碳浓度,有利于平衡正向移动,但二氧化碳浓度过大,减少催化剂对乙苯的吸附;
(3)负极发生氧化反应,苯乙烯被氧化生成苯甲醛;若该电池消耗标准状况下22.4L的O2,即1mol氧气,反应中O元素化合价由0价降低为2价,则转移4mol电子。
(4)由反应物、生成物的总能量比较确定焓变,由图可知AuPF3+对应的活化能小。
(1)①反应热=反应物总键能生成物总能键能,由有机物的结构可知,应是CH2CH3中总键能与CH=CH2、H2总键能之差,故△H=(5×412+3483×412612436)kJmol1=+124kJmol1,故答案为:+124;
②恒压下,加入水蒸气稀释剂,相当于增大容器体积,则使平衡正向移动,增大转化率;高温下,水蒸气可与碳反应增大,可减少积碳,有利于反应进行,发生C+H2O(g)![]() CO+H2,故答案为:增大;C+H2O(g)
CO+H2,故答案为:增大;C+H2O(g)![]() CO+H2;
CO+H2;
(2)由反应历程可知乙苯与二氧化碳在催化条件下反应生成苯乙烯和一氧化碳,增大二氧化碳浓度,有利于平衡正向移动,但二氧化碳浓度过大,会造成催化剂表面乙苯的吸附下降,故答案为:随着CO2压强增大,反应物浓度增大,促进平衡向右移动;过多的CO2会造成催化剂表面乙苯的吸附下降;
(3)负极发生氧化反应,苯乙烯被氧化生成苯甲醛,电极方程式为![]() -8e-+3H2O=
-8e-+3H2O=![]() +8H++CO2;若该电池消耗标准状况下22.4L的O2,即1mol氧气,反应中O元素化合价由0价降低为2价,则转移4mol电子,故答案为:
+8H++CO2;若该电池消耗标准状况下22.4L的O2,即1mol氧气,反应中O元素化合价由0价降低为2价,则转移4mol电子,故答案为:![]() -8e-+3H2O=
-8e-+3H2O=![]() +8H++CO2;4 mol;
+8H++CO2;4 mol;
(4)由反应物、生成物的总能量可知a=129.6kJ/mol0=129.6kJ/mol,由图可知AuPF3+对应的活化能小,则催化效果好,故答案为:129.6;AuPF3+。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】钒及其化合物在工业上有许多用途。某钒精矿的主要成分及质量分数如下表:
物质 | V2O5 | V2O3 | K2O | SiO2 | Fe2O3 | Al2O3 |
质量分数% | 0.81 | 1.70 | 2.11 | 63.91 | 5.86 | 12.51 |
一种从该钒精矿中提取五氧化二钒的流程如下:
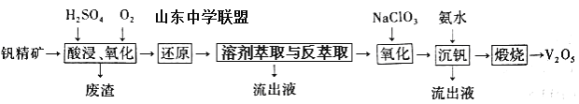
回答下列问题:
(1)“酸浸、氧化”时,V2O3转化为VO2+,反应的离子方程式为____________________________________;若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的黄绿色气体,反应的化学方程式为__________________。
(2)萃取剂对四价钒具有高选择性,且萃取Fe3+而不萃取Fe2+,所以萃取前可用____________(填名称,下同)对浸出液进行“还原”处理。为检验“还原”后的滤液中是否含有Fe3+,可选用的化学试剂是____________________。
(3)“溶剂萃取与反萃取”可表示为:VO2+ + (HR2PO4)2(O)![]() VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
VO(R2PO4)2(O)+ 2H+。其中(HR2PO4)2(O)为萃取剂,为了提高VO2+的产率,反萃取剂应该呈 __________性(填“酸”“碱”或“中”)。
(4)“氧化”中,欲使3molVO2+变为VO2+,则需要氧化剂NaClO3至少为____________mol。
(5)单质钒可用于制造特种合金钢。以五氧化二钒和金属钙为原料在高温条件下可制备单质钒,表示制备过程的化学方程式为________________________________________。