��Ŀ����
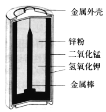
����Ŀ�����������̣�Mn3O4���㷺Ӧ�����������Ų��ϡ��������Ʊ�����һ���Ե�Ʒλ�̿�MnCO3��Mn2O3��MnOOH������Fe2O3��Al2O3��SiO2��Ϊԭ������Mn3O4�Ĺ���������ͼ��

��֪��(NH4)2SO4![]() NH3��+NH4HSO4
NH3��+NH4HSO4
�ش��������⣺
(1)MnOOH��Mn�Ļ��ϼ�Ϊ___��
(2) ���ܽ�����H2O2��������___��
(3) ������2������Ҫ�ɷ���___��
(4) ��ĸҺ�����ʵ���Ҫ�ɷ���___��ѭ�����ø����ʵķ�����___��
(5)������ʱ�����������ˮ�У�70��ˮԡ���ȣ�ͨ����������������ȫ��ת��ΪMn3O4��Mn(OH)2����Mn3O4�Ļ�ѧ����ʽΪ___����Ӧ����ҺpH___������������������С����������������
���𰸡�+3 ��+3��MnԪ�ػ�ԭ��Mn2+ Fe(OH)3��Al(OH)3 (NH4)2SO4 ���ȵ�213~308���ֽ����ɰ�����NH4HSO4���ֱ�ѭ�������̺��ܽ��У����H2SO4����NH4HSO4ѭ�����ܽ��� 6Mn(OH)2+O2![]() 2Mn3O4+6H2O ��С
2Mn3O4+6H2O ��С
��������
�̿��(��MnCO3��Mn2O3��MnOOH������Fe2O3��Al2O3��SiO2)��NH4HSO4��H2O2�ܽ���MnCO3��Mn2O3��MnOOHת��ΪMn2+��Fe2O3��Al2O3ת��ΪFe2+��Al3+��SiO2���ܶ�������1������Mn(OH)2��pH=5����ʱFe3+��Al3+ת��ΪFe(OH)3��Al(OH)3����Ϊ����2�ijɷ֣����백ˮ���̣���ʱ��ת��ΪMn(OH)2��Mn2(OH)2SO4��ͨ����������70��ˮԡ���ȣ�����Mn3O4��
(1)MnOOH��O��-2�ۣ�H��+1�ۣ����ݻ��ϼ۵Ĵ���Ϊ0�������Mn�Ļ��ϼ�Ϊ+3����Ϊ��+3��
(2) ���ܽ����У���һ����Mn��+3�۽�Ϊ+2�ۣ�����H2O2�������ǽ�+3��MnԪ�ػ�ԭ��Mn2+����Ϊ����+3��MnԪ�ػ�ԭ��Mn2+��
(3) �����Ϸ���֪��������2������Ҫ�ɷ���Fe(OH)3��Al(OH)3����Ϊ��Fe(OH)3��Al(OH)3��
(4) �����Ϸ���֪����ĸҺ�����ʵ���Ҫ�ɷ���(NH4)2SO4��ѭ�����ø����ʵķ����Ǽ��ȵ�213~308���ֽ����ɰ�����NH4HSO4���ֱ�ѭ�������̺��ܽ��У����H2SO4����NH4HSO4ѭ�����ܽ��С���Ϊ��(NH4)2SO4�����ȵ�213~308���ֽ����ɰ�����NH4HSO4���ֱ�ѭ�������̺��ܽ��У����H2SO4����NH4HSO4ѭ�����ܽ��У�
(5)������ʱ��Mn(OH)2����70��ˮԡ���ȣ�ͨ��������������Mn3O4����ѧ����ʽΪ6Mn(OH)2+O2![]() 2Mn3O4+6H2O��Mn(OH)2�ʼ��ԣ�Mn3O4������ˮ�����Է�Ӧ����ҺpH��С����Ϊ��6Mn(OH)2+O2
2Mn3O4+6H2O��Mn(OH)2�ʼ��ԣ�Mn3O4������ˮ�����Է�Ӧ����ҺpH��С����Ϊ��6Mn(OH)2+O2![]() 2Mn3O4+6H2O����С��
2Mn3O4+6H2O������

 ������״Ԫ���Ծ�ϵ�д�
������״Ԫ���Ծ�ϵ�д�����Ŀ����ϩ������ϩ������Ҫ�Ļ���ԭ�ϡ�
![]() ��ҵ�Ͽ����ұ������ⷽ���Ʊ�����ϩ
��ҵ�Ͽ����ұ������ⷽ���Ʊ�����ϩ
����֪���ֻ�ѧ���ļ������£�
��ѧ�� | C-H | C-C |
| H-H |
����/(kJ/mol) | 412 | 348 | 612 | 436 |
��![]() +H2(g)��
+H2(g)��![]() ________kJ/mol��
________kJ/mol��
��ʵ�������г��ں�ѹ�����²������ˮ������Ϊ��Ӧ��ϵ��ϡ�ͼ�![]() ˮ�������μӷ�Ӧ
ˮ�������μӷ�Ӧ![]() ����һ��ѹǿ��900 K�������£��ұ���ƽ��ת��������
����һ��ѹǿ��900 K�������£��ұ���ƽ��ת��������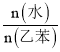 �������________
�������________![]() ��������������������������
��������������С������������![]() �����ŷ�Ӧ�Ľ��У�������̼��ʹ�������Լ�����ˮ�����������ڻָ��������ԣ�ԭ����____________
�����ŷ�Ӧ�Ľ��У�������̼��ʹ�������Լ�����ˮ�����������ڻָ��������ԣ�ԭ����____________![]() �û�ѧ����ʽ��ʾ
�û�ѧ����ʽ��ʾ![]() ��
��
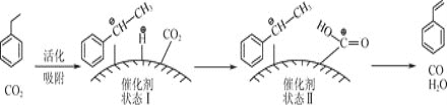
![]() ����ϩ�����ұ���
����ϩ�����ұ���![]() �������Ƶá��䷴Ӧ�������£�
�������Ƶá��䷴Ӧ�������£�
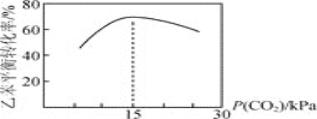
�ұ�ƽ��ת������![]() �Ĺ�ϵ��ͼ��ʾ����P(CO2)< 15 kPaʱ���ұ�ƽ��ת��������
�Ĺ�ϵ��ͼ��ʾ����P(CO2)< 15 kPaʱ���ұ�ƽ��ת��������![]() �����������ԭ����__________����P(CO2)> 15 kPaʱ���ұ�ƽ��ת��������
�����������ԭ����__________����P(CO2)> 15 kPaʱ���ұ�ƽ��ת��������![]() ������С����ԭ����____________��
������С����ԭ����____________��
![]() �о�����������߲���������ܹ�˳����ѡ���Դ���������ϩ���ɱ���ȩ���Ը÷�Ӧԭ����Ƴ�����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ ________�����õ�����ı�״����22.4L��
�о�����������߲���������ܹ�˳����ѡ���Դ���������ϩ���ɱ���ȩ���Ը÷�Ӧԭ����Ƴ�����ȼ�ϵ�أ����ظ����ĵ缫��ӦʽΪ ________�����õ�����ı�״����22.4L��![]() �������·��������ת�Ƶ��ӵ����ʵ���Ϊ________��
�������·��������ת�Ƶ��ӵ����ʵ���Ϊ________��
(4)�Ϻ���ͨ��ѧ��������о��˲�ͬ���������ϩ����![]() �ķ�Ӧ��������ͼ��ʾ��
�ķ�Ӧ��������ͼ��ʾ��

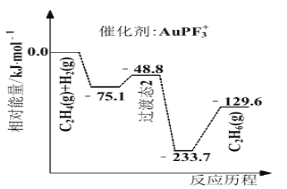
��![]() ____________������ϩ����Ч���ϺõĴ�����________(ѡ����
____________������ϩ����Ч���ϺõĴ�����________(ѡ����![]() ������
������![]() ��)��
��)��