题目内容
2.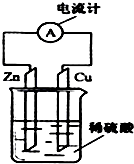 (1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.
(1)如图所示的原电池装置,Cu电极反应式为2H++2e-=H2↑;当导线上通过2.408×1022个电子时,锌片质量减少1.3g.(2)氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池,总反应方程式为2H2+O2═2H2O.其中氢气在负(填“正”或“负”)极发生氧化反应(填“氧化”或“还原”).电路中每转移0.2mol电子,消耗标准状况下H2的体积是2.24L.
分析 (1)该装置构成原电池,锌易失电子作负极、Cu作正极,电极反应式为:Zn-2e-=Zn2+、2H++2e-=H2↑,再结合锌和转移电子之间的关系式计算.
(2)氢氧燃料电池氢气在负极失电子发生氧化反应,根据电极方程式计算消耗的氢气.
解答 解:(1)该装置构成原电池,锌作负极、Cu作正极,负极上锌失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,电子的物质的量=$\frac{2.408×1{0}^{22}}{6.02×1{0}^{23}}$=0.04mol,
设参加反应的Zn的质量为x
Zn-2e-=Zn2+,
65g 2mol
x 0.04mol
65g:2mol=x:0.04mol
x=$\frac{65g×0.04mol}{2mol}$=1.3g,
故答案为:2H++2e-=H2↑;1.3.
(2)氢气具有还原性,在形成原电池反应时,应为负极,被氧化,如为酸性染料电池,负极电极方程式为2H2-4e-═4H+,如为碱性电解质,负极为H2-2e-+2OH-=2H2O,由电极方程式可知,电路中每转移0.2mol电子,则生成0.1mol氢气,体积为0.1mol×22.4L/mol=2.24L,
故答案为:负;氧化;2.24.
点评 本题考查了原电池原理,正确书写电极反应式是解本题关键,题目难度不大,注意把握原电池的组成条件和工作原理,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
12.继“分子足球”C60之后,科学家又发现另一种“分子足球”N60.一定条件下N60中积累的巨大能量会在一瞬间释放出来,是未来的火箭燃料,N60属于( )
| A. | 非金属单质 | B. | 金属单质 | C. | 化合物 | D. | 混合物 |
10.下列各组混合物不论它们的组分以何种比例混合,只要总质量一定,经过完全燃烧后,产生的CO2为一定量的是( )
| A. | 乙烷和乙烯 | B. | 丙烯和丙烷 | ||
| C. | 甲烷和己烷 | D. | 乙炔和乙烯基乙炔( CH2=CH-C≡CH) |
7.已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
| A. | 元素非金属性按X、Y、Z的顺序增强 | |
| B. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| C. | 气态氢化物的稳定性按X、Y、Z的顺序增强 | |
| D. | 单质的氧化性按X、Y、Z的顺序减弱 |
14.下列叙述中不正确的是( )
| A. | 两原子,如果核外电子数相同,则一定属于同种元素 | |
| B. | 两种微粒,若核外电子数相同,则其化学性质一定相同 | |
| C. | 在多电子的原子里不同电子层的核外电子的能量是不相同的 | |
| D. | 能量低的电子在离核近的区域运动 |
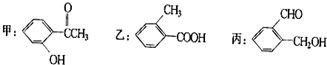 今有化合物:
今有化合物:
 (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基) .
.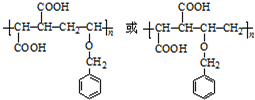 .
.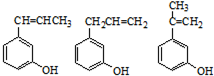 (其中任一种).
(其中任一种).