题目内容
【题目】在工业上常用CO和H2合成甲醇,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
已知:①CO(g)+![]() O2(g)═CO2(g)△H1=akJ/mol
O2(g)═CO2(g)△H1=akJ/mol
②H2(g)+![]() O2(g)═H2O(g)△H2=bkJ/mol
O2(g)═H2O(g)△H2=bkJ/mol
③CH3OH(g)+![]() O2(g)═CO2(g)+2H2O(g)△H3=ckJ/mol
O2(g)═CO2(g)+2H2O(g)△H3=ckJ/mol
回答下列问题:
(1)△H= ______
(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是___________(填字母)。
CH3OH(g)已达平衡状态的是___________(填字母)。
A.单位时间内生成1molCH3OH(g)的同时消耗了1molCO(g)
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
(3)在T1℃时,体积为2L的恒容容器中充人物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与 ![]() 的关系如图所示。
的关系如图所示。

①当起始 ![]() =2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率V(H2)=________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
=2,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率V(H2)=________。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将__________(选填“增大”、“减小”或“不变”);
②当起始 ![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___________点(选填“D”、“E”或“F”)
(4)已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图,则压强p1 ______p2(选填“>” “<” 或“=”);当压强为p2时,在y点:v(正) ______ v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp= ______ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图,则压强p1 ______p2(选填“>” “<” 或“=”);当压强为p2时,在y点:v(正) ______ v(逆)(选填“大于”、“小于”或“等于”)。若p2=3MPa,则T℃时该反应的平衡常数Kp= ______ MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】 (a+2b-c)kJ/mol CD 0.12mol/(L.min) 增大 F < 大于 4
【解析】(1)根据盖斯定律,CO(g)+2H2(g)![]() CH3OH(g),可由①+2②-③得到,故△H=(a+2b-c)kJ/mol ;(2)能说明反应CO(g)+2H2(g)
CH3OH(g),可由①+2②-③得到,故△H=(a+2b-c)kJ/mol ;(2)能说明反应CO(g)+2H2(g)![]() CH3OH(g)已达平衡状态的是A.单位时间内生成1molCH3OH(g)的同时消耗了1molCO(g),两者均表示正速率,故A错误;B.在恒温恒容的容器中,反应混合物全是气体,气体的质量和体积始终保持不变,混合气体的密度保持不变,不能说明达到平衡,故B错误;C.在绝热恒容的容器中,只要平衡移动,就有热效应,反应的平衡常数不再变化,说明已达到平衡,故C正确;D.在恒温恒压的容器中,对于气体体积变化的反应,气体的平均摩尔质量不再变化,说明反应已达到平衡,故D正确;故选CD。(3)①当起始
CH3OH(g)已达平衡状态的是A.单位时间内生成1molCH3OH(g)的同时消耗了1molCO(g),两者均表示正速率,故A错误;B.在恒温恒容的容器中,反应混合物全是气体,气体的质量和体积始终保持不变,混合气体的密度保持不变,不能说明达到平衡,故B错误;C.在绝热恒容的容器中,只要平衡移动,就有热效应,反应的平衡常数不再变化,说明已达到平衡,故C正确;D.在恒温恒压的容器中,对于气体体积变化的反应,气体的平均摩尔质量不再变化,说明反应已达到平衡,故D正确;故选CD。(3)①当起始 ![]() =2,即2molH2、1molCO,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率V(H2)=
=2,即2molH2、1molCO,经过5min达到平衡,CO的转化率为0.6,则0~5min内平均反应速率V(H2)= ![]() =0.12mol/(L.min);若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,
=0.12mol/(L.min);若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol, 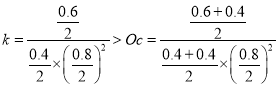 ,平衡正向移动,达新平衡时H2的转化率将增大;②当起始
,平衡正向移动,达新平衡时H2的转化率将增大;②当起始 ![]() =2.0时,达到平衡状态后,CH3OH的体积分数最大,故当起始
=2.0时,达到平衡状态后,CH3OH的体积分数最大,故当起始 ![]() =3.5时,达到平衡状态后,CH3OH的体积分数比C点小,可能是图象中的F;(4)已知CO2(g)+CH4(g)
=3.5时,达到平衡状态后,CH3OH的体积分数比C点小,可能是图象中的F;(4)已知CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图,增大压强,CH4的转化率变小,画等温线,可得,压强p1 <p2;当压强为p2时,在y点:v(正) 大于 v(逆)。若p2=3MPa,则CO2(g)、CH4(g)、CO(g)、H2(g)分压分别是3MPa/6=0.5MPa、0.5MPa、1MPa、1MPa,则T℃时该反应的平衡常数Kp=
2CO(g)+2H2(g)。在密闭容器中有浓度均为0.1molL-1的CH4与CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图,增大压强,CH4的转化率变小,画等温线,可得,压强p1 <p2;当压强为p2时,在y点:v(正) 大于 v(逆)。若p2=3MPa,则CO2(g)、CH4(g)、CO(g)、H2(g)分压分别是3MPa/6=0.5MPa、0.5MPa、1MPa、1MPa,则T℃时该反应的平衡常数Kp=![]() MPa2。
MPa2。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案
