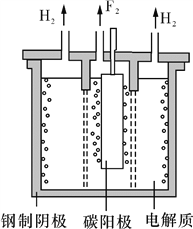
题目内容
【题目】将0.2 mol KMnO4在一定温度下加热后生成a mol O2;将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在。若a+b=m,则m的值可能为( )
A. 0.30 B. 0.35
C. 0.40 D. 0.50
【答案】C
【解析】KMnO4固体在一定温度下加热,反应后的残留固体中与过量的浓盐酸,收集到气体为氯气,根据电子转移守恒,整个过程中,Mn元素获得电子等于O元素、Cl元素获得的电子,则有:0.2×(7-2)=4a+2b,整理得a+b=0.5-a,当高氯酸钾没有分解时,即a=0,(a+b)达极大值,故(a+b)<0.5,当高锰酸钾完全分解生成氧气时,生成氧气最多,生成氯气最少,由2KMnO4![]() K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.2mol×
K2MnO4+MnO2+O2↑,可知生成氧气最大的物质的量为0.2mol×![]() =0.1mol,故a+b≥0.5-0.1=0.4,故选C。
=0.1mol,故a+b≥0.5-0.1=0.4,故选C。

练习册系列答案
相关题目
【题目】己知下表为25℃时某些弱酸的电离平衡常数。依据所给信息判断,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
A. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
B. 相同浓度的CH3COONa和NaClO的混合溶液中,c(CH3COOH)+c(HClO)=c(OH-)-c(H+)
C. 25℃时,0.10mol·L-1Na2CO3溶液通入CO2至溶液的pH=7时,溶液中:c(Na+)=c(CO32-)+ c (HCO3-)+c(H2CO3)
D. 向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中![]() 增大
增大