题目内容
【题目】用双线桥及单线桥表示反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 电子转移情况。
双线桥________________________________________。
单线桥________________________________________。
该反应中氧化剂是:_______。若有4molHNO3参加反应,转移电子的物质的量为______mol。
【答案】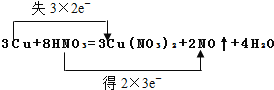
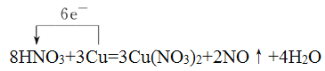 HNO3 3
HNO3 3
【解析】
反应中N元素的化合价降低,Cu元素的化合价升高,结合有关概念和电子得失守恒分析解答。
根据方程式可知氮元素化合价从+5价降低到+2价得到3个电子,铜元素化合价从0价升高到+2价失去2个电子,则根据电子得失守恒可知转移6个电子,因此双线桥表示该反应电子转移的方向和数目为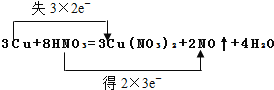 ,单线桥表示该反应电子转移的方向和数目为
,单线桥表示该反应电子转移的方向和数目为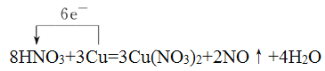 ,因此该反应中氧化剂是HNO3,若有4molHNO3参加反应,消耗1.5mol铜,则转移电子的物质的量为1.5mol×2=3.0mol。
,因此该反应中氧化剂是HNO3,若有4molHNO3参加反应,消耗1.5mol铜,则转移电子的物质的量为1.5mol×2=3.0mol。

 阅读快车系列答案
阅读快车系列答案【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
【题目】用如图装置来分离CO2和CO混合气体并干燥,图中a、c、d为止水夹,b为分液漏斗活塞,通过Y形管和止水夹分别接两个球胆,现装置内空气已排尽,为使实验成功,甲、乙、丙分别盛放的试剂为()

甲 | 乙 | 丙 | |
A | 饱和NaHCO3溶液 | 12 mol·L-1盐酸 | 18.4 mol·L-1 H2SO4 |
B | 饱和Na2CO3溶液 | 2 mol·L-1 H2SO4 | 饱和NaOH溶液 |
C | 饱和NaOH溶液 | 2 mol·L-1 H2SO4 | 18.4 mol·L-1 H2SO4 |
D | 18.4 mol·L-1 H2SO4 | 饱和NaOH溶液 | 18.4 mol·L-1 H2SO4 |
A. A B. B C. C D. D