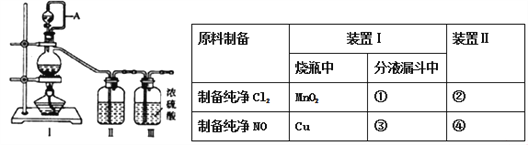
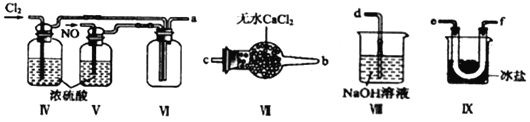
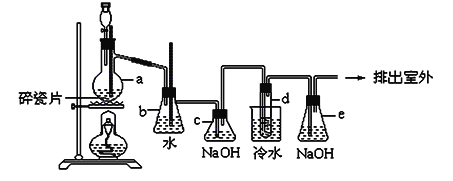
题目内容
【题目】实验室用固体NaOH配制0.5 mol/L的NaOH溶液500 mL,有以下仪器:
①烧杯 ②100 mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)⑦烧瓶
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是____________。
(2)在配制的转移过程中某学生进行如图操作,请指出其中的错误: _______、_______

(3)下列操作会使配制的溶液浓度偏低的是________________(填字母)
A、没有将洗涤液转移到容量瓶 B、转移过程中有少量溶液溅出
C、容量瓶洗净后未干燥 D、定容时俯视刻度线
E、固体NaOH中含有少量Na2O杂质
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)____________
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体直接放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
【答案】①③④⑤⑥ 胶头滴管 未用玻璃棒引流 使用了250mL的容量瓶(或没使用500mL的容量瓶) AB BC
【解析】
(1)根据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;
(2)配制溶液时,应根据配制溶液体积选择容量瓶;移液时应用玻璃棒引流;
(3)分析操作对溶质的物质的量和溶液体积的影响,根据C=![]() 进行误差分析;
进行误差分析;
(4)根据容量瓶构造及使用方法解答。
(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;所以必须的仪器:①③④⑤⑥;还缺少的仪器:胶头滴管;
因此,本题正确答案是:①③④⑤⑥;胶头滴管;
(2)配制0.5mol/L的NaOH溶液500mL应选择500mL容量瓶;移液时应用玻璃棒引流;
因此,本题正确答案是:未用玻璃棒引流、应使用500mL的容量瓶;
(3)A.没有将洗涤液转移到容量瓶,导致溶质的物质的量偏小,溶液浓度偏低,故A选;
B.转移过程中有少量溶液溅出,导致溶质的物质的量偏小,溶液浓度偏低,故B选;
C.容量瓶洗净后未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故D不选;
因此,本题正确答案是:AB;
(4)A.使用容量瓶前应该检验是否漏水,所以A选项是正确的;
B.容量瓶用水洗净后,不能用待配溶液洗涤,否则会影响配制溶液的浓度,故B错误;
C.氢氧化钠有腐蚀性,应在小烧杯中称量,准确称量并放入烧杯中溶解后,要恢复至室温,再把溶液小心倒入容量瓶中,故C错误;
D.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,所以D选项是正确的;
因此,本题正确答案是:BC。

 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案【题目】根据表中信息判断,下列选项正确的是 ( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A. 第①组反应的其余产物只有O2
B. 第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子10 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2