题目内容
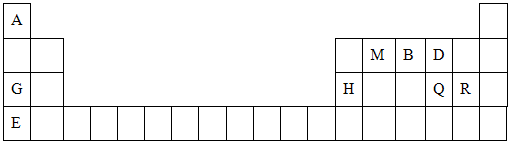
元素周期表是学习物质结构与性质的重要工具.下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素.请用所给元素回答下列问题.
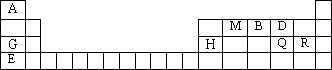
(1)Q元素在元素周期表中的位置________,E元素原子结构示意图为________
(2)E、Q、R三种元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是(填离子符号)________.
(3)M、D两元素形成的化合物中含有的化学键类型是________,其MD2分子的结构式:________.
(4)用表中所给元素组成反应物,用化学方程式说明元素Q和R非金属性的强弱:________;元素G、H的金属性强弱:________.
解析:
|
(1)第三周期ⅥA族,(1分) 示意图略(1分) (2)S2->Cl->K+(2分) (3)共价键(1分) O=C=O(1分) (4)H2S+Cl2=2HCl+S(2分) Al(OH)3+NaOH=NaAlO2+2H2O(其他合理答案也可,2分). |

 阅读快车系列答案
阅读快车系列答案元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
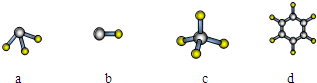
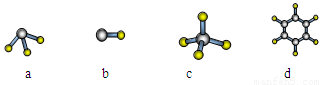
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33 |
164 |