题目内容
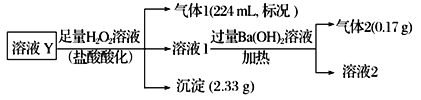
【题目】某无色溶液Y可能含有Na+、Fe3+、Ba2+、NH4+、Cl-、SO42-、HCO3-、HSO3-中的几种离子,溶液中阳离子浓度相同。为了确定其组成,某同学进行了如下实验(假设气体均全部逸出,忽略H2O2的分解)。下列说法不正确的是
A. 溶液Y中一定不存在Fe3+、SO42-
B. 溶液Y中一定含有Cl-,且n(Cl-)=0.01 mol
C. 溶液Y中肯定存在HCO3-、HSO3-、Ba2+、NH4+
D. 溶液Y中可能存在Na+,为确定其是否存在,可取溶液1通过焰色反应实验验证
【答案】B
【解析】因为是无色溶液,因此溶液中不含有Fe3+,加入足量H2O2溶液,出现沉淀,推出原溶液中含有Ba2+,一定不含SO42-,一定含有HSO3-,其中n(Ba2+)=n(HSO3-)=2.33/233mol=0.01mol,加入盐酸酸化的H2O2后,有气体产生,推出原溶液中一定含有HCO3-,n(HCO3-)=224×10-3/22.4mol=0.01mol,加入Ba(OH)2溶液,产生气体,此气体为NH3,n(NH4+)=0.17/17mol=0.01mol,根据溶液呈现电中性,原溶液中一定含有Cl-,因为无法确定是否含有Na+,因此n(Cl-)≥0.01mol,A、根据上述分析,故A说法正确;B、根据上述分析,故B说法错误;C、根据上述分析,故C说法正确;D、检验Na+,需要进行焰色反应,火焰呈黄色,说明含有Na+,故D说法正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目