题目内容
【题目】NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol/LNaHSO3溶液(含少量淀粉)10.0mL、KIO3(过量)酸性溶液40.0mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
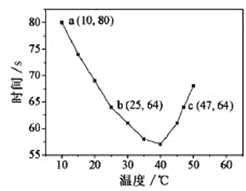
A. 40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B. 图中b、c两点对应的NaHSO3反应速率相等
C. 图中a点对应的NaHSO3反应速率为5.0×10-5mol·L-1·s-1
D. 温度高于40℃时,淀粉不宜用作该实验的指示剂
【答案】B
【解析】试题分析:A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2,故A正确;B.b点的反应原理为:当碘酸钾过量时,生成碘单质,其离子反应式为5SO32-+2IO3-+2H+=5SO42-+I2+H2O,而图中c点的反应原理为2IO3-+5SO2+4H2O=5SO42-+I2+8H+,虽然图中b、c点对应的反应原理不一样,但温度b<c,故反应速率b<c,故B正确;C.a点时间为80s,浓度变化量为![]() =0.004mol/L,a点对应的NaHSO3反应速率为5.0×10-5molL-1s-1,故C正确;D.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,故D错误;故选D。
=0.004mol/L,a点对应的NaHSO3反应速率为5.0×10-5molL-1s-1,故C正确;D.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,故D错误;故选D。

练习册系列答案
相关题目