题目内容
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
① 甲硅烷(SiH4)固态时属于__________ 晶体。
② 已知室温下1g甲硅烷自燃生成SiO2和液态水放出热量44.6kJ,则其热化学方程式为____________。
(2)美国阿波罗宇宙飞船上使用了一种新型电池装置,其构造如下图所示,A、B两个电极均由多孔的炭块组成。该电池的负极反应式为:_____________________。若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为__________。
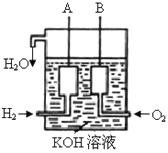
(3)化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是____________。
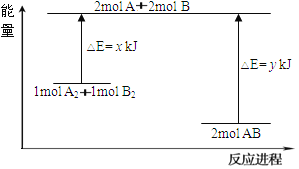
A. 该反应是吸热反应
B. 断裂1mol A-A键和1mol B-B键放出x kJ的能量
C. 断裂2mol A-B键需要吸收y kJ的能量
D. 2mol AB的总能量高于1mol A2和1mol B2的总能量
【答案】分子 SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol H2 - 2 e- + 2 OH-=2H2O 2mol C
【解析】
(1)根据甲硅烷的物理性质分析判断;根据1g甲硅烷燃烧放出的热量计算1mol甲硅烷燃烧放出的热量,进而书写热化学方程式;
(2)在燃料电池中,通入氧气的一极为正极,通入燃料的电极为负极,碱性环境下,氢气反应生成水,据此书写电极反应式,并根据总反应计算;
(3)由图象可知,反应物的能量高于生成物的能量,结合化学键的断裂需要吸收能量分析判断。
(1)①SiH4在常温下为气体,应为分子晶体,故答案为:分子;
②1g甲硅烷的物质的量为![]() =
=![]() mol,放出44.6kJ的热量,则1mol甲硅烷完全燃烧放出的热量为44.6kJ×32=1427.2kJ,热化学方程式为SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol,故答案为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol;
mol,放出44.6kJ的热量,则1mol甲硅烷完全燃烧放出的热量为44.6kJ×32=1427.2kJ,热化学方程式为SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol,故答案为:SiH4(g)+2O2(g)═SiO2(s)+2H2O(l) △H=-1427.2 kJ/mol;
(2)氢气、氧气和氢氧化钾溶液构成了原电池,总反应方程式为:2H2+O2=2H2O,其中通入氢气的电极为负极,通入氧气的电极为正极,负极上氢气失去电子发生氧化反应,电极反应式为H2-2e-+ 2OH-=2H2O;根据2H2+O2=2H2O知,若该电池工作时增加了1molH2O,电路中转移电子为2mol,故答案为:H2-2e-+2OH-=2H2O;2mol;
(3)A、根据图象,反应物的能量高于生成物的能量时,反应是放热反应,故A错误;B、化学键的断裂吸收能量,而不是释放能量,故B错误;C、化学键的断裂吸收能量,由图可知断裂2molA-B键需要吸收ykJ能量,故C正确;D、由图可知,2molAB的总能量低于1molA2和1molB2的总能量,故D错误;故选C。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案