题目内容
【题目】硫化氢气体在资源利用和环境保护等方面均有重要应用。
(1)工业采用高温分解H2S制取氢气,2H2S(g) ![]() 2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
2H2(g) + S2(g),在膜反应器中分离出H2。在容积为 2L 的恒容密闭容器中,控制不同温度进行此反应。H2S的起始物质的量均为 1mol,实验过程中测得H2S的转化率如图所示。曲线 a 表示H2S的平衡转化率与温度的关系,曲线 b 表示不同温度下反应经过相同时间时H2S的转化率。
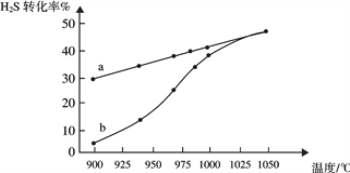
①反应2H2S(g) ![]() 2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
2H2(g) + S2(g)的ΔH_________(填“>”“<”或“=”)0。
②985℃时,反应经过5 s达到平衡状态,此时H2S的转化率为40%,则用H2表示的反应速率为v(H2) =___________。
③随着H2S分解温度的升高,曲线b向曲线a逐渐靠近,其原因是___________。
(2)将H2S和空气的混合气体通入FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如下图所示。
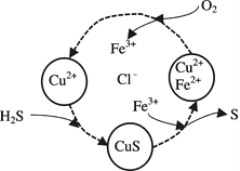
①在图示的转化中,化合价不变的元素是____________。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____________。
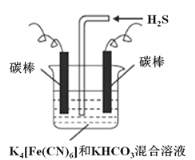
(3)工业上常采用上图电解装置电解K4[Fe(CN)6]和KHCO3混合溶液,电解一段时间后,通入H2S 加以处理。利用生成的铁的化合物K3[Fe(CN)6]将气态废弃物中的H2S 转化为可利用的S,自身转化为K4[Fe(CN)6]。
①电解时,阳极的电极反应式为___________。
②当有16 g S析出时,阴极产生的气体在标准状况下的体积为___________。
【答案】 > 0.04mol/(L·s) 温度升高,反应速率加快,达到平衡所需时间缩短 Cu、Cl、H 增加氧气的通入量或增加起始时c(Fe3+) Fe(CN)6]4--e-=[Fe(CN)6]3- 11.2L
【解析】(1)①根据温度升高,转化率增大,可知平衡正移分析;②根据转化率求出反应的量,再求反应速率;③根据温度对速率的影响分析;
(2)①根据图中各元素化合价变化分析;②欲使生成的硫单质中不含CuS,则硫离子不能剩余,硫离子完全被氧化为S单质,据此分析;
(3)①电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;②因为H2S转化为可利用的S,则当有16gS析出时,转移![]() ×2=1mol电子,又电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,根据转移电子数相等计算。
×2=1mol电子,又电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,根据转移电子数相等计算。
(1)①由图象可知,温度升高,转化率增大,则平衡正移,所以正方向为吸热方向,即△H>0,故答案为:>;
②H2S的起始浓度均为![]() molL-1,若985℃时,反应经5s达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为
molL-1,若985℃时,反应经5s达到平衡,此时H2S的转化率为40%,则参加反应的硫化氢为![]() molL-1×40%=0.2molL-1,v=
molL-1×40%=0.2molL-1,v=![]() =
=![]() molL-1s-1=0.04molL-1s-1,故答案为:0.04molL-1s-1;
molL-1s-1=0.04molL-1s-1,故答案为:0.04molL-1s-1;
③随着温度升高,反应速率逐渐加快,达到平衡所需时间缩短,所以曲线b向曲线a逼近,故答案为:温度升高,反应速率加快,达到平衡所需时间缩短;
(2)①根据图中各元素化合价知,Cu元素化合价都是+2价、H元素化合价都是+1价、Cl元素化合价都是-1价,所以化合价不变的是Cu、H、Cl元素,故答案为:Cu、H、Cl;
②欲使生成的硫单质中不含CuS,则硫离子不能剩余,即硫离子完全被氧化为S单质,所以氧气必须过量,采取的措施可以是提高混合气体中空气的比例、增加氧气的通入量或增加起始时c(Fe3+),故答案为:提高混合气体中空气的比例、增加氧气的通入量或增加起始时c(Fe3+);
(3)①电解时阳极发生失电子的氧化反应,将[Fe(CN)6]4-转化为Fe(CN)6]3-,则电极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3-,故答案为:[Fe(CN)6]4--e-═[Fe(CN)6]3-;
②因为H2S转化为可利用的S,则当有16gS析出时,转移![]() ×2=1mol电子,又电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,所以根据转移电子数相等,阴极产生的气体在标准状况下的体积为
×2=1mol电子,又电解时阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,所以根据转移电子数相等,阴极产生的气体在标准状况下的体积为![]() mol×22.4L/mol=11.2L,故答案为:11.2L。
mol×22.4L/mol=11.2L,故答案为:11.2L。