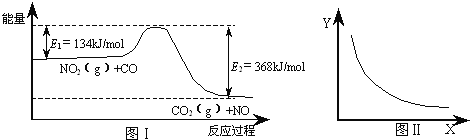
题目内容
【题目】室温下,向20mL浓度均为0.1mol/L的NaOH和MOH溶液中分别滴加0. 1mol/L盐酸,溶液的pH随盐酸体积变化如图所示。下列说法不正确的是( )
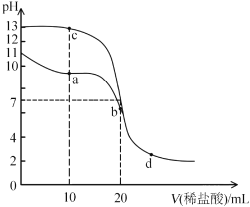
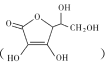
A.MOH的电离常数约为1×l0-5B.a点溶液中存在![]()
C.b点和c点溶液混合后显碱性D.水的电离程度:d>b>a
【答案】D
【解析】
A.据图知,0.1molL1MOH溶液中pH=11,则c(OH)=0.001molL1,MOH电离程度较小,则c(M+)≈c(OH)=0.001molL1,c(MOH)≈0.1molL1,常温下,MOH的电离常数![]() ,A正确;
,A正确;
B.a点溶液呈碱性,则c(H+)<c(OH),根据电荷守恒得c(M+)+c(H+)=c(OH)+c(Cl),所以得c(M+)>c(Cl)≈![]() ,B正确;
,B正确;
C.当盐酸的体积为10mL时,c点溶液为等物质的量浓度![]() 的NaCl和NaOH溶液,当盐酸的体积为20mL时,b点为0.05molL1的MCl溶液,是强酸弱碱盐,水解过程微弱,所以b点和c点溶液混合后显碱性,C正确;
的NaCl和NaOH溶液,当盐酸的体积为20mL时,b点为0.05molL1的MCl溶液,是强酸弱碱盐,水解过程微弱,所以b点和c点溶液混合后显碱性,C正确;
D. a点有碱溶液、d点酸过量,水的电离均受到抑制,b点溶质是强酸弱碱盐,水解时促进水电离,从a到b点水的电离程度增大,从b到d点水的电离程度减小,故D错误;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】某探究小组利用丙酮的溴代反应(CH3COCH3+Br2![]() CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率 v(Br2) 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
CH3COCH3 | HCl | Br2 | ||
① | 0.80 | 0.20 | 0.0010 | 290 |
② | 1.60 | 0.20 | 0.0010 | 145 |
③ | 0.80 | 0.40 | 0.0010 | 145 |
④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大