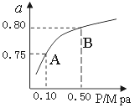
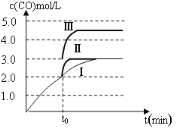
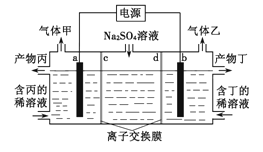
��Ŀ����
����Ŀ���ϳɰ���ӦΪ N2(g)+3H2(g) ![]() 2NH3(g)��H=+92.4kJmol��1������˵����ȷ����( ��
2NH3(g)��H=+92.4kJmol��1������˵����ȷ����( ��
A��һ�������£���N2������������N2�ķֽ��������ʱ���÷�Ӧ����ƽ��״̬
B��ȡ1mol N2��3mol H2�����ܱ������ڷ�Ӧ��ƽ��ʱ������2 mol NH3
C��һ�������·�Ӧ�ﵽƽ�⣬�ٳ���N2��������Ӧ���������淴Ӧ���ʼ�С
D��һ�������·�Ӧ�ﵽƽ�⣬�������¶ȣ���Ӧ��������ƽ��������Ӧ�����ƶ�
���𰸡�A
��������
���������A��һ�������£���N2������������N2�ķֽ�������ȣ�˵�����淴Ӧ������ȣ��ﵽ��ƽ�⣬��A��ȷ��B���÷�ӦΪ���淴Ӧ��������ȫ��Ӧ�����ɵ� NH3С��2mol����B����C������N2��Ũ���������淴Ӧ���ʶ�����������Ӧ���ʴ����淴Ӧ���ʣ���C����D���÷�Ӧ���ȣ������¶ȣ���Ӧ��������ƽ�������ȷ�Ӧ�����ƶ������淴Ӧ����D������ѡA��

��ϰ��ϵ�д�
�����Ŀ