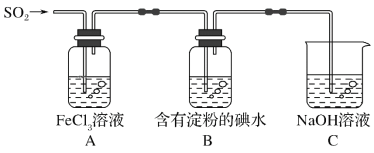
题目内容
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa。常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示。下列说法正确的是

A. pH=3.50时,c(H2A)>c(HA-)>c(A2-)
B. 随着 HCl 的通入 c(H+)/c(H2A)先减小后增大
C. 将等浓度等体积的 Na2A 与 H2A 溶液混合后,溶液显碱性
D. pH从3.00到5.30时,c(H2A)+c(HA-)+c(A2-)先增大后减小
【答案】B
【解析】
根据H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-,pH变化时,HA-的浓度不断变化,因此pC变化幅度不大的曲线,即图中随着pH的增大,pC先减小后增大的曲线是HA-的物质的量浓度的负对数;pH越大,c(H+)越小,则电离平衡正向移动程度越大,所以由图可知:随着pH的增大,pC增大的曲线是H2A的物质的量浓度的负对数,随着pH的增大,pC减小的曲线是A2-的物质的量浓度的负对数,据此答题。
H++A2-,pH变化时,HA-的浓度不断变化,因此pC变化幅度不大的曲线,即图中随着pH的增大,pC先减小后增大的曲线是HA-的物质的量浓度的负对数;pH越大,c(H+)越小,则电离平衡正向移动程度越大,所以由图可知:随着pH的增大,pC增大的曲线是H2A的物质的量浓度的负对数,随着pH的增大,pC减小的曲线是A2-的物质的量浓度的负对数,据此答题。
A.pH=3.50时,pC(A2-)>pC(HA-),所以c(HA-)>c(A2-)>c(H2A),故A错误;
B.一开始通入HCl时,H+与电离出来的OH-不断中和,故c(H+)/c(H2A)减小,反应一段时间后,H2A不断电离,浓度减小,H+的浓度越来越大,故c(H+)/c(H2A)增大,故B正确;
C.将等浓度等体积的Na2A与H2A溶液混合后,电离平衡时溶液呈酸性,故C错误;
D.根据物料守恒,c(H2A)+c(HA-)+c(A2-)始终不变,故D错误。
故选B。

【题目】下表是元素周期表的一部分,按要求填空:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)在这些元素中,最活泼的金属元素与最活泼的非金属元素形成的化合物是:_____(填化学式)。
(2)元素③、④、⑤的最高价氧化物的水化物中碱性最强的物质的电子式是:_______________;元素⑥、⑦、⑧的最高价氧化物的水化物的酸性最弱是_____________(填化学式)。③⑤⑧三种物质最高价的氧化物对应水化物两两能相互发生反应,写出⑤的最高价氧化物的水化物分别与③、⑧的最高价氧化物对应水化物反应的离子方程式_______________
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1
2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1
则反应N2O5(g)=2NO2(g)+ ![]() O2(g)的ΔH=_______ kJ·mol1。
O2(g)的ΔH=_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高