题目内容
【题目】汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( )

A.PbO2是电池的负极
B.Pb是电池的负极
C.PbO2得电子,被氧化
D.电池放电时,溶液的酸性增强
【答案】B
【解析】
根据放电时的电池反应:PbO2+Pb+2H2SO4=2PbSO4+2H2O可知,Pb在放电时失去电子被氧化,为电池的负极,PbO2在放电时得到电子被还原,为电池的正极,放电过程中消耗了硫酸,酸性减弱,据此解答。
A.由放电反应PbO2+Pb+2H2SO4=2PbSO4+2H2O可知,PbO2在放电时得到电子被还原,为电池的正极,A错误;
B.根据放电反应可知,Pb失去电子被氧化,为电池的负极, B正确;
C.PbO2在放电时得到电子被还原,C错误;
D.由于电池放电过程中消耗了硫酸,溶液中氢离子浓度逐渐减小,溶液的酸性减弱,D错误。
答案选B。

【题目】某学习小组用0.80 mol/L标准浓度的烧碱溶液测定未知浓度的盐酸。
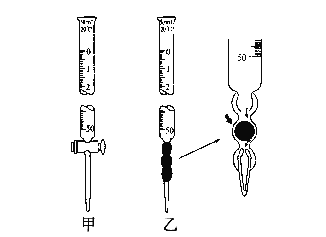
(1).滴定管如图所示,用______滴定管盛装标准浓度的氢氧化钠溶液 (填“甲”或“乙”)。
(2).用滴定的方法来测定盐酸的浓度,实验数据如下所示:
实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
1 | 20.00 | 23.00 |
2 | 20.00 | 23.10 |
3 | 20.00 | 22.90 |
该实验中用去标准液的体积为________ml。
(3).下列操作会使所测得的盐酸的浓度偏低的是________。
A.盛装待测液的锥形瓶用水洗后未干燥
B.滴定前,碱式滴定管尖端有气泡,滴定后气泡消失
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数
(4).滴定过程中,眼睛应注视________;在铁架台上垫一张白纸,其目的是_______________;
若用酚酞作指示剂,则判断达到滴定终点时的现象是__________________。
(5).根据上表数据,计算被测盐酸的物质的量浓度是________mol/L。(小数点后保留两位有效数字)