题目内容
2013年初,全国各地多个城市都遭遇“十面霾伏”,造成“阴霾天”的主要根源之一是汽车尾气和燃煤尾气排放出来的固体小颗粒PM2.5.催化剂汽车尾气净化的主要原理为:2NO(g)+2CO(g)
2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图1所示.据此判断:
(1)该反应为 反应(放热、吸热);在T2温度下,0~2s内的平均反应速率:υ(N2)= ;
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在如图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图2正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号).(如图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量和质量)

| 催化剂 |
(1)该反应为
(2)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在如图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图2正确且能说明反应在进行到t1时刻达到平衡状态的是

考点:化学平衡状态的判断,反应速率的定量表示方法,化学平衡的影响因素,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据到达平衡的时间判断温度高低,根据平衡时二氧化碳的浓度判断温度对平衡的影响;
由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=
计算v(CO2),再根据速率之比等于化学计量数之比计算v(N2);
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同;
(3)A.到达平衡后正、逆速率相等,不再变化;
B.到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C.t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D.到达平衡后各组分的含量不发生变化.
由图可知,T2温度平衡时,二氧化碳的浓度变化量为0.1mol/L,根据v=
| △c |
| t |
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同;
(3)A.到达平衡后正、逆速率相等,不再变化;
B.到达平衡后,温度为定值,平衡常数不变,结合反应热判断随反应进行容器内温度变化,判断温度对化学平衡常数的影响;
C.t1时刻后二氧化碳、NO的物质的量发生变化,最后不再变化;
D.到达平衡后各组分的含量不发生变化.
解答:
解:(1)由图1可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,
由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=
0.05mol/(L?s),速率之比等于化学计量数之比,故v(N2)=0.5v(CO2)=0.5×0.05mol/(L?s)=0.025mol/(L?s),
故答案为:放热;0.025mol/(L?s);
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: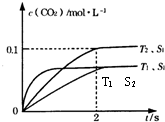 ,
,
故答案为: ;
;
(3)A.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确,
故答案为:BD.
由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=
| 0.1mol/L |
| 2s |
故答案为:放热;0.025mol/(L?s);
(2)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为:
 ,
,故答案为:
 ;
;(3)A.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故A错误;
B.该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,故B正确,
C、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故C错误;
D、NO的质量分数为定值,t1时刻处于平衡状态,故D正确,
故答案为:BD.
点评:本题考查化学平衡图象、化学反应速率、影响化学平衡的因素、平衡常数计算等,题目综合性较大,较难,是对知识的综合利用、注意基础知识的理解掌握.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
近年来,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点.假如硅作为一种普遍使用的新型能源被开发利用,其有利因素的下列说法中你认为不妥当的是( )
| A、硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料 |
| B、硅的来源丰富,易于开采,且可再生 |
| C、硅燃料放出的热量大,且燃料产物对环境污染较低,容易有效控制 |
| D、寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量,是硅能源大规模开发利用的一项关键技术 |
某粒子M的结构示意图为 ,下列有关该粒子的说法中不正确的是( )
,下列有关该粒子的说法中不正确的是( )
 ,下列有关该粒子的说法中不正确的是( )
,下列有关该粒子的说法中不正确的是( )| A、x值有6种以上的可能 |
| B、M粒子的符号可能是O2-、Ne、Al3+等 |
| C、M粒子表示的阴离子中还原性最弱的是N3- |
| D、取含有M粒子的溶液进行焰色反应,若为黄色,则M的符号是Na+ |
常温时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A、饱和碳酸钠溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
| B、pH=2的醋酸中:c(H+)=0.02mol?L-1 |
| C、0.1mol?L-1氯化铵溶液中:c(H+)>c(OH-)>c(Cl-)>c(NH4+) |
| D、pH=12的NaOH溶液与等体积0.01mol?L-1氯化铵溶液混合后所得溶液中:c(Na+)=c(NH4+) |

 :
: :
: :
: :
: