题目内容
20.某饱和一元酸跟足量金属钠反应生成0.5gH2.等量的该醇经充分燃烧后生成H2O36g.则该醇应是( )| A. | 甲醇 | B. | 乙醇 | C. | 丙醇 | D. | 丁醇 |
分析 根据n=$\frac{m}{M}$计算H2O、H2的物质的量,金属与醇反应,醇中-OH中的氢原子被还原生成氢气,根据H原子守恒可知,n(一元醇)=2n(H2),再求出1个醇分子中含有氢原子的个数,据此结合选项判断.
解答 解:醇和钠反应,生成氢气,实际反应的方程式是2ROH+2Na=2RONa+H2,0.5gH2的物质的量0.25mol,是根据方程式醇的物质的量就是0.25×2=0.5mol,36g水的物质的量是2mol中含有4mol氢原子,即1个醇分子中含有8个氢原子,且为饱和一元醇.
故选C.
点评 本题考查有机物分子式的确定,比较基础,判断氢气与一元醇的物质的量关系是关键.

练习册系列答案
相关题目
10.硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | 稳定性:H2Se>AsH3 |
11.下列关于乙炔制取的说法不正确的是( )
| A. | 为了加快反应速率可用饱和食盐水代替水反应 | |
| B. | 此反应是放热反应 | |
| C. | 反应中不需加碎瓷片作沸石 | |
| D. | 为了除去杂质气体,除了用硫酸铜外还可用氢氧化钠溶液 |
8.区别棉花和羊毛最简便的方法是( )
| A. | 加稀硫酸水解 | B. | 浸入水中 | C. | 加入碘水 | D. | 火上灼烧闻气味 |
15.下列过程属于取代反应的是( )
| A. | 苯与碘水混合振荡,水层颜色变浅发生萃取 | |
| B. | 乙烯使溴水褪色 | |
| C. | 甲烷与氯气光照下反应 | |
| D. | 乙烯与氯化氢在一定条件下反应制取纯净的一氯乙烷 |
5.分子式为C7H2402的有机物Q,在稀硫酸存在下能发生反应生成M、N,其中M的相对分子质量为60,下列有关说法中一定正确的是( )
| A. | Q可能有8种同分异构体 | B. | Q不可能有4种同分异构体 | ||
| C. | N只有2种同分异构体 | D. | M只有4种同分异构体 |
9.下列不属于影响离子晶体结构的因素是 ( )
| A. | 晶体中阴、阳离子的半径比 | B. | 离子晶体的晶格能 | ||
| C. | 晶体中阴、阳离子的电荷比 | D. | 离子键的纯粹程度 |
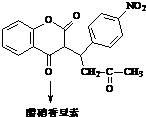
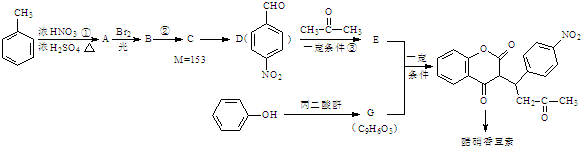
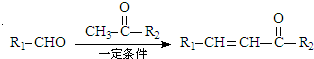 +H2O
+H2O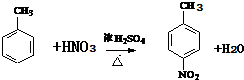 .
.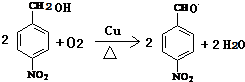 .
.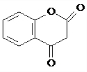 .
.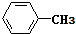 互为同系物;
互为同系物;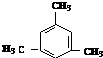 .
.
 .
.